統計的言語学習
認知的枯渇による成人の暗黙の統計的学習の解き明かし
エレオノーレ・H・M・スマル、大黒達也、アルノー・スマレック、ワウテル・デュイック、リッカ・モットーネン
意義
統計的学習機構は、幼児期から成人期までの環境におけるパターンの抽出を可能にする。例えば、連続的な音声ストリームを新しい単語に分割することができる。成人は、受動的に音声を聞いているときでさえ、隠れた単語を意識するようになるのが普通である。しかし、認知発達や脳の成熟が、暗黙の統計的学習(すなわち、幼児のような無意識の学習)にどのような影響を及ぼすかは、まだ十分に理解されていない。本研究では、非侵襲的な脳刺激や認知的課題によって認知制御系が枯渇すると、成人の暗黙的単語分割能力が向上するが、明示的単語分割能力は向上しないことを明らかにした。これらの知見は、成人の認知構造が、早期言語習得に寄与すると考えられる統計的学習メカニズムを制約していることを示唆しており、成人の言語学習能力を向上させる道を開くものである。
概要
人間の学習は、異なる速度で成熟し、主に協力的に、時には競争的に相互作用する複数の神経メカニズムによって支えられている。我々は、成熟した認知メカニズムが、早期言語習得に寄与する暗黙の統計的学習メカニズムを抑制しているという仮説を検証した。具体的には、成人の認知制御機構を枯渇させると、暗黙的な聴覚的単語分割能力が向上するという予測を検証した。若年成人は、無声映画を見ながら、隠れた新語を繰り返す音節の連続的な流れにさらされた。その後、隠された単語と非単語を対比させる強制選択試験で学習を測定した。また、明示的知識と暗黙的知識を分離するために、参加者は単語を明示的に思い出したかどうかを示さなければならなかった。さらに、繰り返される単語に対する神経同調を測定するために、曝露中の脳波を測定した。認知メカニズムの関与は、2つの方法を用いて操作した。実験1(n = 36)では、抑制性シータバースト刺激(TBS)を左背外側前頭前野または対照部位に与えた。実験2(n = 60)では、参加者は、高または低レベルの認知疲労を誘発する二重作業記憶課題を行った。両実験において、認知的疲労は、特に、参加者が単語を覚えている自信がないと報告した場合(すなわち、暗黙の知識があった場合)、単語認識を増強した。さらに、TBSは、単語や音節に対する神経同調を調節した。これらの結果は、認知的枯渇が暗黙の統計的学習メカニズムを解き放つことによって成人の言語知識の習得を改善することを示唆し、成人の言語学習が高次認知メカニズムによって拮抗されるという仮説を支持するものである。
聴覚統計学習
暗黙の学習
脳波計
認知負荷
経頭蓋磁気刺激
人間の学習は、脳の2つの基本的な記憶システム、すなわち宣言的記憶と非宣言的記憶との相互作用によって支えられていると考えられている(1)。宣言的記憶は、事実/出来事の想起や認識といった、自発的、明示的、注意に基づくプロセスを特徴とし、内側側頭葉と前頭前野の構造によって媒介されている(2)。一方、非宣言的記憶は手続き的記憶とも呼ばれ、暗黙的記憶の一部であり、異質な技能、習慣、手続きの習得を含んでいる。これは、大脳基底核、小脳、新皮質構造、および前頭前野の一部(例えば、ブローカ野(3⇓-5))が介在している。
人間の技能学習において、この2つの記憶システムの間に競争関係があることを裏付ける証拠が蓄積されている。反復経頭蓋磁気刺激(TMS)、気晴らし課題、飲酒、催眠、ベンゾジアゼピン系薬剤の摂取、認知疲労などの介入によって宣言的記憶系を抑制すると、連続反応時間課題(6⇓⇓11)や直観推論課題(12)など、暗黙知、知覚-運動学習課題でのパフォーマンスが実際に向上することがあります。これらの知見は、宣言的記憶に関連し、前頭前野によってサポートされている高次の認知機能が、暗黙の学習プロセスによって自然に引き起こされる行動を妨害しうることを示唆している(13)。しかし、競合する記憶システムが、乳幼児の早期かつ迅速な言語習得に不可欠な暗黙の統計的学習能力にも影響を及ぼすかどうかは、まだ未解決のままである(14)。このことは、なぜ幼児や児童が大人よりも少ない努力で言語を習得できるのか(「私たちは何を知らないのか」を参照)を説明できる可能性があり、重要な問題である(15)。
言語習得には、手続き的記憶と宣言的記憶の両方に依存する多くの異なる記憶と学習の過程が含まれる(2, 16)。幼児が言語を獲得するための最初のステップは、自分の音声言語システムにおける音韻構造、音声の組み合わせ方に関する確率的制約(=音韻学習)、連続音声の区分(=語形)についての知識を得ることである(17)。語形学習は生後12ヶ月で既に行われ、その後の語彙獲得(=形と意味の対応付け)やより複雑な言語獲得(=文法)の重要な前段階となる(18)。本研究では、言語習得の初期段階における単語分割、ひいては新規単語形式の学習に寄与する統計的学習メカニズムに着目している。
統計的学習とは、一般に、頻度の高い規則性や分布の性質を抽出することで、環境中のパターンを拾い上げる能力として知られている。この用語は、Saffran, Aslin, and Newport (1996) (19) の研究によって認知心理学の分野に初めて紹介された。彼らは、わずか8ヶ月齢の乳児が、音節間の推移確率以外に手がかりがない連続した音声ストリームから単語の境界を抽出し新規単語形を分割できることを証明したのである。その後、この学習は年長者や成人においても実証され(20, 21)、異なる領域(例えば、音楽、文法)や様式(例えば、聴覚、視覚、運動)(22, 23)にわたって実証された。これは、統計学習が人間のライフスパンにわたるスキル獲得において、ほぼ連続的かつ領域共通の学習機構であることを示している。
典型的な統計的学習実験では、人工文法の子音列や反復音節の三連符などのパターン刺激に繰り返し暴露されます。学習は、通常、曝露後に2択の強制選択認識課題を用いて評価される。この課題では、曝露ストリームからの3連音節がフォイルと比較される。参加者は、2つの三連音符のうち、どちらが最も聞き覚えがあるかを示さなければならず、確率以上の正確さが学習の指標とされる。統計的学習は指示や学習意図なしに起こるので、しばしば暗黙の記憶表象に帰結すると仮定される(24)。この考え方は、乳児や眠っている新生児でも統計的学習が起こるという証拠からも支持されている(25)。しかし、Batterinkらは最近の研究で、学習意図がなくても、成人が統計的学習中に主に新奇な語形に関する明示的な知識を獲得することを示した(26⇓⇓-29)。このことは、参加者が三重項を覚えている自信があるときは偶然を上回る成績を示し、自信がないときは偶然に近い成績を示したという観察から導き出すことができる。参加者が何を学んだかの自覚がない場合、知識は暗黙的である。つまり、自信がないときにも偶然より高いパフォーマンスを示した場合、知識は暗黙的であると推論される(30)。一方、自信のないときに偶然の成績であれば、暗黙の知識は得られない。統計的学習は、認識・記憶判断課題では評価できない暗黙知をさらに生み出す可能性があるが(例えば、文献28)、Batterinkの以前の発見は、成人が獲得した単語知識を主に明示的記憶系に保存することを示した。
私たちなどは、前頭前野の認知発達や成熟が、語形や文法学習などの言語習得にマイナスの影響を与えることを提唱してきた(31⇓⇓⇓-35) 。例えば、我々は、Hebb反復学習パラダイム(隠れた繰り返し単語からなる音節列を直ちに想起させる記憶パラダイム)において、子どもが大人より優れていることを示した(32, 33)。興味深いことに、我々はその後の研究で、宣言的記憶と認知制御に密接に関連する領域である左背外側前頭前皮質(DLPFC)へのTMSによる認知機能低下が、成人参加者のHebbパフォーマンスを高めることを見いだしました(34)。このことは、後期発達の前頭前野の認知機構が、環境から順次言語情報を効率的に獲得するための変化を誘発することを示唆しており、以前に報告された技能学習における証拠とほぼ一致するものである(13)。最近、我々は、成人の認知的疲労下で音韻制約学習が増強されることを示し、この考えをさらに裏付けた(35)。これらの知見に基づき、我々は、成人の高次認知制御システムは、暗黙の記憶プロセスへのアクセスを減少させ、それによって言語習得の効率を幼児や子供に比して低下させる可能性があると仮定する。この考えは、音韻や文法などの言語習得の発達的変化を注意や記憶能力の成熟的変化に帰する、よく知られたless-is-more仮説と一致する(36⇓-38)。私たちの先行研究では、参加者は音節列を記憶すること(34)や生成すること(35)を明示的に求められたので、新規言語への曝露は受動的、すなわち「幼児的」なものではありませんでした。また、暗黙的な記憶表現と明示的な記憶表現を分けて考えることはしなかった。このように、幼児の言語習得を支援する統計的学習メカニズムを用いて連続音声を受動的に聴取する際に、高次の認知機能が暗黙の言語知識の習得にどのように影響するかは未解決である(23, 39)。
本研究の目的は、聴覚統計学習パラダイムを用いてこの疑問に直接答えることであった。特に、2つの異なる介入を用いて高次認知制御系を一時的に枯渇させることで、幼児の単語分割に役立つ成人の暗黙の統計的学習過程を解除できるかどうかを明らかにすることを目指した。そのために、我々は無声映画を鑑賞しながら、3音節の擬似単語を繰り返す未知の音節の連続ストリームを若年成人に暴露した。最初の実験では、抑制性連続シータバースト刺激を用いて、Smalleら、2017(34)で用いた方法と同様に、曝露前に左DLPFCまたは対照部位に長期的な混乱を誘発した。第2実験では、参加者はまず、その後の認知パフォーマンスを阻害する認知疲労を誘発する高または低認知負荷(HCLおよびLCL、それぞれ)条件下で努力型二重作業記憶課題を行うか(7、35、40)、言語曝露前に認知負荷課題を行わなかった(コントロールまたは無負荷条件)。統計的学習の主要な指標は、曝露後15分後に評価された隠語のオフライン認識であった。これは、被験者が隠された単語を覚えているとどの程度確信しているかを測定する記憶判定手順と組み合わされたものである。この課題は、明示的記憶表現と暗黙的記憶表現を分離するものである(例えば、文献27⇓-29, 41)。両実験とも、統計的学習の第二の独立した指標としてオンライン知覚成分を調べるため、20分間の言語曝露中に脳波も測定した。これまでの研究で、3音節構造の繰り返しからなる連続音声を聞いているとき、脳の定常反応は個々の音節の周波数で減少し、3音節の単語のリズムで増加することが示されている。このような神経同調の変化は、聴覚曝露の機能として新規単語のオンライン統計的学習を示す(29)。全体として、TMSによるDLPFCの破壊(実験1)と認知疲労(実験2)が統計的言語学習を促進し、特に隠れた新語に対する暗黙の記憶表現を強化すると予測された。
結果
認知力低下が隠語の認知に及ぼす影響。
実験1.
参加者は、統計的学習を示す強制選択認識課題において、両群とも偶然以上の成績を収めた(すなわち、DLPFC:平均=68.8, SE=3.5, t17=5.4, P<0.001, d=1.3; Vertex:平均=57.3, SE=3.4, t17=2.2, P<0.05, d=0.5 )。TMSによるDLPFCの破壊は、隠れた単語の認識精度を向上させた[TMSの効果:β=0.28、SE=0.096、Z=2.87;X2 (1) = 8.25, P = 0.004, d = 0.6, 図1]。自信のない反応(全試行の64%、TMS中断群31%、対照群33%)については、中断群では精度が偶然を有意に上回ったが(平均63.9、SE=3.7、t17=3.8、P < 0.001 、d=0.9)、対照群ではそうではなかった(平均51.7、SE=3.8、t < 1、P = 0.33 、d = 0.1).コントロール群とディスラプション群には有意差があった[TMSの主効果:β=0.23、SE=0.108、Z=2.16、X2 (1) =4.68、P=0.030、d=0.5]。自信に満ちた回答(全試行の36%、TMS阻害群19%、対照群17%)では、すべての参加者がチャンス以上の精度を示した(DLPFC:平均75.9、SE=6.0、t17=4.3、P<0.001、d=1.0、Vertex:平均66.3、SE=7.8、t16=2.08、P<0.05、d=0.5)。群間に有意差はなかった[TMSの主効果:β=0.35、SE=0.214、Z=1.62、X2 (1) =2.63、P=0.11]。
図1.
統計的単語分割を反映した行動結果。上段は実験1(左)、実験2(右)における認知妨害の関数として、隠れた単語に対する総認識精度(%)を示す。下図は、被験者が隠れた単語を覚えている自信がない、または自信があると答えたときの、隠れた単語の認識精度を示している(それぞれ、自信なし、自信あり、と呼ぶ)。自信のある回答は、明示的に記憶されている知識を反映している。自信のない回答でチャンス以上の成績を収めた場合は、暗黙の記憶として保存されている知識を反映している。エラーバーはSEMを表す。アステリスクは片側t検定で有意であることを示す。*P < 0.05, **P < 0.01, **P < 0.001, ns, nonsignificant.
実験2.
強制選択式認識課題では、全グループで統計的学習を示す偶然以上の成績を収めた(高負荷:平均64.7、SE=2.7、t19=5.4、P<0.001、d=1.2;低負荷:平均65.6、SE=3.9、t19=4.0、P<0.001、d=0.9;負荷なし:平均55.3、SE=2.7、t19=1.9、P < 0.05,db = 0.4).認知負荷は、隠れた単語の認識精度を向上させた[認知負荷の効果:高対対照:β=0.42, SE=0.19, Z=2.23, P=0.026, d=0.4; 低対対照:β=0.46, SE=0.19, Z=2.47, P=0.013, d=0.5; X2 (2) = 7.50, P= 0.024, Fig.1].自信のない回答(全試行の64%、高負荷群21%、低負荷群20%、無負荷群24%)については、高認識負荷群で偶然を上回る精度が得られた(平均値=61.8、SE=3.8、t19=3.08, P < 0.01, d = 0.7)、低認知負荷群(mean = 57.8, SE = 4.7, t19 = 1.64, P = 0.05, d = 0.4)でも、認知負荷なし群(平均 51.3, SE = 4.5, t < 1, P = 0.4, d = 0.07)でも、精度は偶然を上回りました。認知負荷は対照群に比べて精度を高めた[高対対照:β=0.52, SE=0.20, Z=2.57, P=0.01, d=0.5; 低対対照: β=0.37, SE=0.20, Z=1. 81, P=0.070, d=0.4; 認知負荷の主効果。x2 (2) = 7.16, P = 0.028]であった。自信のある回答(全試行の36%、高負荷群12%、低負荷群14%、無負荷群10%)については、すべての群で確率以上の精度を示した(高認識負荷:平均=66.0、SE=6.0、無負荷群:平均=66.0、SE=6.0、無負荷群:平均=66.0)。5, t19 = 2.5, P = 0.012, d = 0.6; 低い認知負荷: 平均 = 75.1, SE = 6.3, t19 = 4.0, P < 0.001, d = 0.9; 認知負荷なし: 平均 = 68.7, SE = 5.7, t19 = 3.3, P < 0.01, d = 0.7).群間に有意差は認められなかった[高対コントロール:β=-0.012, SE=0.45, Z=-0.028, P=0.98;低対コントロール:β=0.43, SE=0.46, Z=0. 94, P=0.35; 認識負荷の主効果。x2 (2) = 1.24, P = 0.54]であった。
曝露時の神経エントレインメントに対する認知的枯渇の影響。
実験1.
試行間コヒーレンス(ITC)は、ランダムな音節ストリームへの曝露に比べ、単語周波数で増加(P = 0.01, Cohenのd = 1.1)したが、音節周波数で減少(P = 0.003, d = 1.4) しました[周波数×曝露:F (1, 31) = 16.4, P < 0.001, Fig 2].左DLPFCをTMSで破壊すると、神経性単語学習指数(WLI)が上昇した[Exposure:F (1, 30) = 31.6, P < 0.001、TMS×Exposure:F (1, 30) = 5.6, P = 0.025, random:P = 0.6, d = 0.2, 構造化:P = 0.004、d = 1.1、Fig.3]。
図2.
図2.
オンライン統計学習を反映した脳波の結果。実験1(TMS)と実験2(認知負荷)でランダム配列と構造化配列に暴露したときのITC(6つの前頭中心正中線電極、FC1、FC2、F3、F4、FC5、Fzの平均値)。頭皮全体のITCの分布を、曝露量と周波数の関数として示したトポグラフィカル・プロット。ITCの値はWLI(ITC word / ITC syllable)の算出に用いられた(Fig.3)。
図3.
オンライン統計学習を反映した脳波の結果。認知的破壊の有無(実験1:TMS、実験2:認知的負荷)によるWLIの変化(ランダムシーケンスと構造化シーケンス)。エラーバーはSEMを示す。
実験2.
ITCはランダムな音節配列への曝露に比べ、単語頻度では増加したが(P < 0.001, d = 1.4)、音節頻度では減少した(P = 0.08, Cohenのd = 0.5) [Frequency × Exposure: F (1, 57) = 19.3, P < 0.001, Fig 2].認知的負荷は神経性WLIに影響を与えなかった[Exposure:F (1, 55) = 40.4, P < 0.001, 負荷 × Exposure:認知負荷は神経WLIに影響を与えなかった[曝露:F (2, 55) = 1.04, P = 0.36, Fig 3]。
考察
全体として、今回の結果は、言語習得の初期段階における単語分割に寄与する高次認知制御機能と暗黙の統計的学習メカニズムとの間の競合的相互作用を示す証拠を提供するものである。具体的には、若年成人において、左DLPFCへのTMS印加(実験1)および認知疲労の誘発(実験2)により、認知制御機構を枯渇させた。これらの長期的な効果を持つ介入は、三音節の単語パターンからなる連続的な音声ストリームに曝露する前に適用された。このとき、単語の境界を示す音響的な手がかりは与えられなかった。TMSによる左DLPFCの破壊と認知的疲労は、いずれも隠れた単語に対する認識精度を高め、統計的学習が促進されたことを示している。さらに、これらの認知操作は、被験者が単語を覚えている自信がない場合に、特に認識精度を向上させることがわかり、暗黙の統計的学習が促進されたことが示されました。実際、対照成人は、暗黙の記憶の単語に対して偶然レベルの認識精度を示したが、これは成人における先行研究(27⇓-29)と一致する。一方、認知機能低下成人は、偶然レベルを超える認識精度を示した。この結果は、認知機能低下により、成人の暗黙の単語分割能力が解放されることを示唆している。
すべてのグループが、隠れた単語を覚えているという確信が高いときに、チャンス以上の認識精度を示し、明示的な統計的学習が行われていることが示された。認知操作は、明示的な統計的学習には影響を与えなかった。このことは、認知操作が明示的あるいは宣言的な学習機構を低下させた可能性があるため、重要である。この結果は、暗黙的な統計的学習の増強が、明示的な記憶形成を犠牲にして行われなかったことを示唆しており、暗黙的学習と明示的学習の直接的な競合という考えを完全に支持するものではありません。これらの結果は、暗黙的統計学習は発達過程で利用可能であるが(39)、成人の脳では「ボトルネック」が生じ、明示的記憶システムへのアクセスが優先されるという考えとより一致する(42)。高次認知制御機構を破壊すると、この「ボトルネック」が解消され、その結果、成人の言語知識を暗黙記憶と顕在記憶の両系統に同時に保存する能力が向上する。その結果、言語認知の全体的な向上が期待できる。このモデルを検証し、高次認知システムの促進が、暗黙的言語知識の獲得と明示的言語知識の獲得にどのような影響を及ぼすかを調べるために、さらなる研究が必要である。
私たちの実験パラダイムでは、実験1、2の記憶テストを行う前に、認知操作から回復させるために、曝露後に休憩を入れた。この遅延が、エピソード記憶よりも暗黙的記憶の定着を強化し、参加者がストリームからの単語を明示的に記憶する可能性を低下させた可能性がある。実際、両実験において、参加者は全試行のうち36%しか確信が持てなかった。しかし、記憶判断(すなわち、自信のある回答対自信のない回答の割合)は、TMSや認知疲労の影響を受けなかった。認知操作は、15分の遅延の後、自信のない回答の正確さに特に影響を与えたが、自信のある回答の正確さには影響を与えなかった。この効果が短いコンソリデーション期間に依存するのか、コンソリデーション期間を長くすることでこの効果がさらに強まるのか、さらなる研究が必要である。
さらに、学習の第二の独立した指標として、構造化音節ストリームを受動的に聞いている間に、隣接する音節を単語に結合する知覚を調べるために、統計的学習中の神経同調を測定しました。BatterinkとPaller(2017)による最近の知見に基づいて予想されるように、神経同調は構造化された曝露の関数として、音節の周波数で減少し、一方、単語のレベルで増加した(29)。これは、すべての参加者において、知覚的結合が成功したことを示している。しかし、興味深いことに、TMSによる左DLPFCの破壊は、この知覚的結合(WLIで測定)を増強したが、認知疲労はこれに影響を与えなかった。しかし、TMSと認知疲労は、暴露後の認識課題で測定した単語に対する記憶を増強した。これらの知見は、統計的学習の知覚的結合(「処理ベース」とも呼ばれる)要素(ここではオンライン脳波で測定)は、統計的学習の記憶貯蔵または検索要素(ここではオフライン認識課題で測定)と分離可能であるという見解と一致する(26, 43, 44)。このことは、オンラインとオフラインの測定値の間に相関がないことからも裏付けられる(SI Appendix)。TMSによるDLPFCの破壊は、シータ振動(4〜8Hz)とアルファ振動(8〜12Hz)のパワーをわずかに高め、特に頭頂・後頭部のアルファ振動を著しく高めることがわかった(SI Appendix)。一方、認知的疲労は、デルタ(1〜4Hz)振動のパワーを低下させた。このことは、認知操作が異なる神経的帰結をもたらしたことを示唆している。シータおよび低アルファのパワーは幼児期に強く、認知発達の過程で減少する(例えば、文献45, 46)。デルタやシータなどの低周波振動のパワーは、成人期になっても減少し続ける(47)。したがって、この結果から、左DLPFCの破壊が若年成人を幼児と同じように機能させ、その結果、統計的学習の知覚的結合と暗黙の記憶の両要素が増強されたとする暫定的な解釈が導かれる。しかし、認知疲労の操作は、成人期における認知機能の低下を模倣している可能性がある。統計的言語学習と暗黙の運動学習は、高齢者でもよく保存されていることが示されている(20, 48⇓⇓-51)。
今回の結果は、TMSによるDLPFCの破壊および/または認知疲労が運動系(6、7)や言語系(34、35)のシーケンス学習を促進することを示した先行研究とほぼ一致している。本研究では、明示的な指示がない場合(すなわち、暴露中の受動的リスニング)、統計的言語学習の暗黙的対明示的結果に対する認知的枯渇の効果を実証し、2つの異なる方法を用いてこれらの効果を再現するものである。TMSによるディスラプションと認知的疲労の2つの方法を用いて、これらの効果を再現した。以前の研究では、高い認知負荷のみが認知疲労感を誘発し、運動配列学習が改善されることを見出した(7)。我々は、低負荷タスクと高負荷タスクの両方が参加者サンプルの認知疲労感を増加させ、その結果、統計的言語学習が両群で(認知負荷タスクを行わない対照条件と比較して)促進されることを見出した。
統計的言語学習は、海馬(44)、下前頭皮質(52)、線条体(53)、聴覚-運動経路(54)など、複数の脳領域と経路が並行して機能していることに依存している。しかし、これらの脳領域や経路が、構造化された音列から言語知識の暗黙的記憶表現と明示的記憶表現の獲得にどのように寄与しているかについては、まだ十分に理解されていない。また、前頭前野の認知制御機構が様々な言語学習機構間の競争や協調にどのような影響を及ぼすのかも、今後の重要な研究課題である。
本研究は、認知制御系が成人の暗黙の言語学習能力を制約しているという仮説の因果関係を示す実験である。成熟した認知システムを枯渇させると、初期の言語習得に用いられる暗黙の統計的学習メカニズムが強化されることを明らかにした。この発見は、言語学習における成熟期の制約や個人差(言語関連の困難さなど)の理解につながる可能性があり、ヒトの言語発達科学における重要なステップとなる。重要なことは、認知的枯渇が幼児のような暗黙の学習メカニズムを解き放つ鍵となり、その結果、成人の外国語学習を促進する可能性があることです。
材料と方法
参加者
同様の従属尺度を用いたBatterinkらの先行研究(28)、および今回と同一のTMSパラダイムを用いた我々の先行研究(34)で大きな効果量が得られたことから、各群20名ずつで試験を行うことにした。我々の以前の研究では、DLPFC破壊群(n = 14、Hebb試行の最終ブロックの平均正解率 = 89.3%、SD = 16.04%)と対照群(n = 14、平均正解率 = 72.5%、SD = 21.9%)間のHebb学習成績の差のt検定効果量dは0.88であった。回収後に英語を流暢に話せない4人を除外した後、左DLPFC刺激(n = 18、年齢 = 25.3M ± 4.8SD、女性9人)またはVertexへの対照刺激(n = 18、年齢 = 23.4M ± 5.0SD、女性12人)にランダムに割り当てられた実験1の36人のデータを報告します。3名の参加者(TMS群2名、対照群1名)では、技術的な不具合により脳波が記録されなかった。しかし、これらの参加者のデータは行動解析に含まれる。実験2では、高負荷(n = 20、年齢 = 22.7M ± 3.1SD、女性12人)、低負荷(n = 20、年齢 = 21.8M ± 3.9SD、女性16人)、無負荷(すなわちコントロール、n = 20、年齢 = 18.8M ± 0.81SD、女性16人)にランダムに割り当てられた60人のデータを報告する。2名(対照群1名、低負荷群1名)の脳波記録は技術的な不具合のためないが、その行動データは解析に含まれる。参加者は全員右利きで、英語を母国語とする者(または母国語ではないが流暢に話す者)であった。参加者は全員、言語(学習)障害や神経学的問題の既往歴はなかった。すべてのグループの参加者は、さまざまな認知制御能力においてマッチしていた(表1)。実験は、インフォームド・コンセントのもと、研究の目的を伏せて行われた。参加者は実験終了時に金銭的補償(10ポンド/時間)を受けた。本研究は、ノッティンガム大学心理学部の研究倫理委員会により承認された(参考文献:F1003)。
表1.
参加者の特徴各グループの事前テストによる個人の認知制御能力
実験デザイン
プレテストでは、個人の認知制御能力を評価した(表1)。実験2の参加者は、さらに最大処理速度能力(すなわち、85%以上の精度を維持しながら2つのワーキングメモリ課題を同時に行うための最短処理時間間隔)についての事前テストを受けた。この評価は、実験2[認知疲労(実験2)]における実験的認知負荷操作のために必要であった。両実験とも、主実験は別の日に行われ、その間、両実験参加者は脳波を記録しながら20分間の聴覚的音節ストリームに曝された。実験参加者は15分間の休憩の後、隠された単語に関する暗黙的および明示的な記憶を調べる曝露後認識テストを行った。主な実験デザインはFig.4に示す。
図4.
図4.
実験1および2の主な手順:実験1では、参加者は曝露前にDLPFCまたは頂点のいずれかにcTBSを受けた。実験2では、参加者はHCLまたはLCL条件下で二重作業記憶課題を行ったか、または曝露前に課題を行わなかった。曝露はランダムストリームで5分間行われ、その後構造化ストリームが20分間提示された。5分ごとに短い休憩(10秒)が入れられた。脳波は終始記録された。参加者は暴露中、無音の自然ドキュメンタリー番組を視聴した。15分間の休憩の後、参加者は暴露後の認識テストを行い、記憶判断により隠された単語に関する暗黙的および明示的な記憶を調査した。曝露中および休憩中、参加者は行動テストに音節の断片が含まれることを意識していなかった。
TMS(実験1)。
TMSはDuoMAG XT刺激装置(Deymed社、Brainbox Ltd)に取り付けた直径70mmの8の字型コイルを用いて行った。まず、BeamF3アルゴリズム(55, 56)を用いて、各参加者の左DLPFCを局在させた。そして、安静時の対側手において信頼性の高い痙攣を誘発するスポットとして、左運動野を同定した。このとき、被験者の手指を軽く収縮させた状態で、TMSが10回中5回以上の筋痙攣を誘発する最小強度を能動運動閾値(aMT)と定義した。被験者のaMTを定義した後、以前のTMS研究(34)と同様に、コイルを左DLPFCまたは対照領域(頂点より2cm後方)に配置した。制御領域は、統計的学習や認知制御に関与しないものとした(57)。コイルの位置(すなわち、DLPFCまたはVertex)は、実験に入る参加者の数に基づいてランダムに決定された。コイルは、DLPFCでは前後軸に対して45°の角度で、対照部位では0°でハンドルを後方に向け、頭皮に接するように設置した。刺激強度は各参加者のaMTの80%[すなわち、DLPFC群では43.7%(SD=6.3)、対照群では49.3%(SD=8.3)]に設定された。Smalleら、2017(34)と同様に、600パルスが200バーストの連続列車で送達される修正された連続シータバースト刺激(cTBS)プロトコルが使用された。各バーストは、6 Hzで繰り返される30 Hzの3つのパルスで構成されていた。このプロトコルは一次運動野を刺激した後、少なくとも30分間皮質の興奮を抑制することが知られている(58)。重要なことは、DLPFCへのcTBSはメタ認知や意識的な知覚過程を損なわないということである(59)。
認知的疲労(実験2)。
TloadDback課題を用いて認知疲労を誘発した(40)。TloadDbackタスクのスクリプトはOpen Science Framework (https://osf.io/ay6er)で自由に利用可能である。タスクはDellのノートパソコン(リフレッシュレート60Hz)上のMatlab2016b/Psychtoolboxで実行された。文字は15.6インチのスクリーンにArial、フォントサイズ120で集中的に提示された。各参加者について、2つの継続的な課題要求、すなわちn-back文字検出とパリティ数決定を正確に処理するために必要な最短時間が、最初の評価日の事前テストで定義された(実験デザイン)。TloadDback課題では、画面上に数字(1〜4、6〜9)と文字(A、C、T、L、N、E、U、P)が交互に提示された。参加者は、表示された文字が前回見た文字と同じになるたびに左手でスペースバーを押し、その後に表示された数字が奇数(テンキーの「1」を押す)か偶数(「2」を押す)かを右手で指示するよう指示された。2つの課題は、参加者の事前テストによる最大処理速度能力に基づいて異なるペースで提示され、異なるレベルの認知的負荷が生じた(先験的なグループ差はない;表1)。これは、85%以上の精度を達成できる最速の刺激時間(STD)と定義される。HCL条件下では、課題は被験者の最大処理速度で16分間実施された。一方、LCL条件では、提示速度を1/3遅くした(STD=max.STD+1/2max.STD)。この結果、前者の方が(課題の複雑さは同じでも)持続的な注意制御要求が高くなり、最終的に「認知的枯渇または精神疲労」(7, 40)の状態が高くなることがわかった。予想通り、LCL参加者はHCL参加者よりも高い二重課題遂行能力を示し、彼らは事前テストで定義された最小限の85%の精度レベルで遂行した(すなわち、93.3M ± 4.3SD 対 81.5M ± 13.1SD, t38 = 23.1, P < 0.001, それぞれ)。無負荷条件の参加者は、直ちにFig.4に示すような主実験に取り掛かった。TloadDback課題の直前と直後(すなわち暴露前)に、疲労を評価する簡単な数値自己報告式評価尺度(1:精神疲労を感じない~10:最悪の精神疲労を感じる)を提示し、認知疲労の誘発を素早く操作で確認することができるようにした。認知負荷課題を行わなかった参加者は、認知負荷課題を行った参加者(すなわち、5.3M±1.9SD;P = 0.001)よりも、曝露前に低い主観的疲労感を報告した(すなわち、4.2M ± 2.01SD )。しかし、予想に反して、高負荷者と低負荷者の間には信頼できる差はなかった(すなわち、5.6M ± 2.1SD 対 5.0M ± 2.3SD, P = 0.21)。実験開始時に検査した認知疲労のベースライン主観報告には、全群で差はなかった(すなわち、すべてのPs>0.23)。
暴露(実験1、2)。
子音-母音構造のユニークな12音節を選択し、4つの新規語形(すなわち、/tu:paɪroʊ/, /goʊlɑ:bu:/, /bi:dɑ:ku:/, および /pɑ:di:tɑ:/)に構成しました。各語形内の個々の音節は、被験者間で1位、2位、3位に出現するため、各刺激群において、被験者1〜7は上記のような語形にさらされ、被験者8〜14は/paɪroʊtu.の語形にさらされることになった。/、/lɑ:bu:goʊ/、/dɑ:ku:bi:/ および /di:tɑ:pɑ:/、被験者15から21は /roʊtu:paɪ/、/bu:goʊlɑ:/、/ku:bi:dɑ:/ および/tɑ:pɑ:di:/ という単語形式を与えた。これは、単語内の音節の位置の好みによって引き起こされる可能性のある刺激駆動効果を最小限に抑えるために行われました。すべての言語リストにおいて、単語は英語の平均的な音標文字確率で一致した(Ps > 0.40)。12音節はオンライン人工音声合成装置を用いてイギリス英語の女性の声で録音した。音声ファイルは250ミリ秒に編集され、Audacityソフトウェアを使ってサンプリングレート44,100 Hzで保存された。
参加者は、連続した音声が聞こえることを知らされ、その音を注意深く聞くように指示された。隠された構造についての情報は与えられず、また聞き取った音節列のセグメントに対する暴露後のテストについての情報も与えられず、したがって言語暴露は暗黙のうちに行われた。暴露は常にランダムストリームから開始され、12音節すべてが高次構造を持たずに疑似ランダムな順序で連結された。唯一の制約は、音節が繰り返されないことと、新規単語のアナグラムが現れないことであった。このストリームでは、900の音節が提示された(各音節は75回繰り返された)。ランダムストリームの後、20分間の構造化ストリームが開始され、音声は4つの繰り返し三音節語にグループ化された(図4)。ここで、単語内の隣接する音節間の遷移確率は100、単語間では33%であった。例えば、被験者1〜3では、ストリーム中の/tu:/の後には必ず/paɪ/が続き、/roʊ/の後には、同様に/goʊ/, /bi:/, /pɑ:/が続く可能性があることが分かりました。
合計で、1,200の繰り返し単語(各単語は300回繰り返される)と3,600の音節(ランダムブロックの音節を加えたもの)が提示された。刺激開始の非同期性は、実験1では320ms、実験2では310msであった(この実験間の10msの差は意図的なものではない)。音声ストリームはPresentationソフトウェア(version 18.0, Neurobehavioral Systems, Inc; www.neurobs.com)を用いて提示された。音節は、Dellのデスクトップコンピュータに取り付けられたイヤホンを通して、各参加者にとって快適な聴取レベルで提示された。暴露中、参加者はサイレントモード(すなわち、字幕や音声なし)で「プラネットアース」のエピソードを視聴した。5分ごとに10秒の休憩が入り、スクリーンに表示される指示に従って、音に耳を傾けるよう参加者に促した。
脳波の記録と解析(実験1、2)。
TMS対応脳波計(TruScan Research by Deymed, Brainbox Ltd.)を用い、キャップマウント型電極27個(Fp1、Fp2、Fz、F3、F4、F7、F8、FC1、FC2、FC5、FC6、Cz、C3、C4、T3、T4、CP1、CP2、CP5、CP6、Pz、P3、P4、T5、T6、O1、O2)により、脳波計を記録しました。鼻電極はリファレンスとして使用し、額に取り付けた電極は記録中のグランドとして使用した。水平・垂直電気粘液図(EOG)は、目頭と右目の上下に設置した電極でバイポーラ方式で記録した。電極のインピーダンスは10 kΩ以下に保った。信号は0.1〜1,000Hzのバンドパスフィルタでオンラインフィルタリングし、サンプリングレート3,000Hzで記録した。
脳波データの解析は、MATLAB環境下で動作するオープンソースのツールボックスであるEEGLABを用いて行った(60)。連続生データファイルは、左右の乳様突起の代数平均に再参照され、500Hzにダウンサンプリングされ、30Hzのローパスフィルタでフィルタリングされた。不良チャンネルは特定され、必要に応じて補間された。参加者一人当たりの平均補間チャンネル数は、実験1では0.18であったが、実験2では補間されたチャンネルはなかった。強い筋肉アーチファクト、電極ドリフト、技術的アーチファクトを含むEEG信号の期間は、さらなる分析から除外された。実験1(TMS)では、非常にノイズの多い脳波活動のため、1人の参加者(対照群)が除外されたが、実験2では、余分な参加者は除外されなかった。独立成分分析を用いて連続データを線形分解し、頭皮センサーのアーチファクト源(スロードリフト、目の瞬き/動き、筋アーチファクト)の寄与を除去した。データは5,000ミリ秒のエポックに分割された(単語条件では各単語の開始に対して-2,000ミリ秒から3,000ミリ秒、ランダム条件では3音節毎)。振幅変化が±70μV(EOGチャンネルを含む)を超えるものは、さらなる分析から除外した(試行の20%未満)。選択的反応の平均化は、各ブロックで別々に行った。
各条件(単語対音節/ランダム対構造化)におけるITCを測定することで、音節および単語周波数における神経同調を定量化した。ITCはphase-locking valueと呼ばれ、事象関連位相ロックの指標となる。ITC値が高いほど、エポック間の位相同期が高いことを意味する。すなわち、ITC値は0から1まであり、純粋に位相ロックしていない活動から厳密に位相ロックしている活動まである。ITCは、0.5Hzから5Hzまで0.1Hzステップで計算し、連続モレットウェーブレット変換を用いた。この変換では、高い周波数でより良い周波数分解能を得るために、1サイクル長から周波数に対して線形にサイクル数を増加させた。この手法により、低周波での時間分解能と高周波での周波数分解能のトレードオフを最適化することができる(60)。そして、各エポックにおけるITC値を平均化した。
実験1と2では、単語の提示周波数は1.0Hzと1.1Hz、音節の提示周波数は3.1Hzと3.2Hzであった。もし被験者が連続音声中の単語構造に敏感になれば、ランダム音声に比べ構造化音声では単語周波数でのITCが高くなり、音節周波数でのITCが低くなるはずである。つまり、被験者が新奇な単語を学習した場合、個々の音節ではなく、基本的な単語への神経振動の同調が優先的に変化することが予想されます。これは、WLI(WLI = ITC word frequency / ITC syllable frequency)と呼ばれる簡単な式で指標化することもできる(29)。WLIは、単語と音節の周波数におけるITCが最も強い値を示した6つの前頭中心正中線電極(すなわち、FC1、FC2、F3、F4、FC5、Fz;電極間のITCに関する補足文書は、我々のオープンサイエンスリポジトリ(https://osf.io/dequ9/)にあります)間で計算されました。
強制選択認識課題(実験1、2)。
約15分間の休憩の後、脳波計を外し、洗髪を行い、二者択一の強制認識課題に取り組んだ。各試行では、固定十字を呈示しながら、標的3音節文字列(隠語)と箔3音節文字列(非語)の聴覚提示を、刺激間間隔1,500msで行った。非単語の箔は、同じ12音節のリストから作成され、単語形式に構成されていた。ただし、フォイル内の音節は音声ストリーム内で互いに後続しないこと、単語の境界をまたがないことが唯一の制約であった。すべての単語と非単語のフォイルは、英語の平均的な音標文字確率で一致した(Ps > 0.70)。課題は、1) 2つの文字列のどちらがより聞き覚えがあるかを示すこと、2) その想起判断(「暴露から想起した」対「聞き覚えがあるが、はっきり覚えていない」または「推測した」)であった。思い出した」文字列を自信のある反応とし、「記憶がなく聞き覚えがある」または「推測した」文字列を自信のない反応と呼ぶ。次の試行は、参加者が回答を入力してから1500ms後に開始された。音節文字列は暴露時と同じ速度で提示された。4つのターゲットと4つのフォイルのそれぞれを網羅的にペアリングし、合計16回の試行を行った。試行の半分では、ターゲットに続いてフォイルが提示され、残りの半分では、フォイルに続いてターゲットが提示された。呈示順序は参加者間でカウンターバランスされた。
統計解析(実験1、2)。
認知機能低下の言語学習への影響を調べるため、脳波データ(すなわち、ITC値とWLI指数)に対して線形混合効果分析を行い、行動データ(すなわち、認識精度)に対して階層型ロジスティック回帰分析を行った。これらの解析は、R(R Development Core Team, 2011)のlme4パッケージ(61)およびafexパッケージ(62)を用いて行った。我々は常に、デザインによって正当化される最大限のランダム効果構造を含むモデルに努めた(61, 62)。収束に問題がある場合(例:特異なフィット)、まずランダムスロープ間の相関を除去し、次に推定分散の最も小さい高次のランダムスロープを除去して、最大限のモデルを再フィットした(62)。P値は、afexパッケージのANOVA機能で自由度に対するKenward-Roger近似を使用して導き出された(63)。実験2のグループ因子を除き、すべての固定因子に効果符号化を行い、認知負荷なしを参照水準とするダミー符号化を行った。すべての計画的検定にボンフェローニ補正が用いられた。モデルの推定値に対するCohenのd効果量は、emmeansパッケージのeff_size関数を用いて算出した(64)。研究間の比較を可能にし、二次解析(例えば、検出力計算やメタ解析)を容易にするため、SI Appendixにt検定の効果量も記載している。さらに、1標本のt検定を行い、認識課題における自信のない反応と自信のある反応について、確率以上のパフォーマンスを検定した。実験1の対照者1名は、すべての試行で自信がないと報告したため、自信のある回答は得られなかった。刺激材料とデータファイル(解析用スクリプトを含む)は、オープンサイエンス・リポジトリで公開されている: https://osf.io/dequ9/).
データの入手方法
匿名化されたデータファイルと解析用スクリプトは、外部(https://osf.io/dequ9/)に寄託されている(65)。
謝辞
データ収集にご協力いただいたCristina Pancotto、Afrina Sallehuddin、Ayaka Tsuchiyaに感謝する。E.H.M.S.はResearch Foundation - Flanders (Grant No. 1211421N)からの助成金によって資金提供された。T.D.はサントリー文化財団のトラベルグラントの助成を受けた。研究費用は、ノッティンガム大学心理学部からのスタートアップ資金によって賄われ、TMSとEEGの機器は、R.M.への医学研究評議会フェローシップ(G1000566)により支援された。R.M.は、フィンランドアカデミーからヘルシンキ大学への Profi5 (Mind and Matter) 資金も提供された。
嚥下障害のマネジメント
嚥下障害マネジメントの最近の進歩
ジョセフ・トリッグスほか F1000Res.2019.
無料PMC論文
詳細を表示
全文リンク
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6719674/#!po=10.3774
引用元
概要
嚥下障害とは、文字どおり「食べることの障害」である。しかし、臨床の場ではより正確に、食物や液体が食道や胸部に詰まる感覚と表現される。この感覚が痛みを伴う場合はオディノファジア、持続的な閉塞感やボーラス貯留を伴う場合はフードインパクションに分類されます。研究や技術の進歩により、私たちはこの愁訴に関連する病因や根本的な病態生理についての理解を深め続けています。しかし、今のところ、我々の臨床アルゴリズムは、嚥下障害を閉塞性嚥下障害、食道運動障害、機能性嚥下障害の3つに分類し、内視鏡検査とマノメトリー検査に重点を置いています。ここでは、現在の臨床診断における重要なピットフォール、新たに提唱された食道運動障害の基礎メカニズム、診断と治療に役立つ開発技術について概説する。
キーワードEGJOO、FLIP、嚥下障害、食道、ジャックハンマー、マノメトリー。
利益相反に関する声明
競合する利益JEPはCrospon社のストックオプションを持ち、Medtronic社およびSandhill Scientific社のコンサルタントを務め、Medtronic社から助成金を受け、Medtronic社、Sandhill Scientific社、武田薬品、AstraZenecaから講演料を受領しています。JRTは、競合する利害関係がないことを宣言している。Mario Costantiniは、Joseph R. TriggsおよびJohn E. Pandolfinoと、過去3年間に1つのコンソーシアム論文で共同研究していますCompeting interests:John Clarkeは、John Pandolfinoと共に、2018年のスタンフォードの食道運動不全シンポジウムに参加しました。競合する利益Rami Sweisは、Joseph R. TriggsおよびJohn E. Pandolfinoと、過去3年間に2つのコンソーシアム論文で共同研究しています。
はじめに
嚥下障害は、ボーラス通過障害の原因となる機械的または炎症性プロセスの証拠の有無と、その部位に基づいて区分される。最初の分類は、口腔咽頭の病因があるか、異常が上部食道括約筋より下にあるかということに焦点が当てられている。この中咽頭嚥下障害と食道嚥下障害の区別は、通常、嚥下時の即時誤嚥や咳の有無、鼻咽頭逆流、声の変化、開始時に協調しない嚥下があるという認識などの他の症状に焦点を当てた注意深い病歴から知ることができる。食道嚥下障害では、症状をのどに限局すると、しばしば誤解を招くことがある。胸部での著しいボーラス貯留や収容不良は、咽頭の閉塞と混同されることがある。脳神経機能の検査を行い、患者が水を飲み込んだり、固形物を食べたりするのを観察することは非常に有用である。中咽頭嚥下障害が疑われる場合は、言語聴覚士によるビデオ透視嚥下検査を行い、欠損部を特定する必要がある2.
食道嚥下障害が疑われる患者には、上部内視鏡検査を行うべきである。この検査は機械的閉塞や炎症プロセスを除外するのに役立ち、また食道運動障害である可能性を示す証拠となる。実際、食道症状に対する治療法としては、まず上部内視鏡検査が行われ、治療可能な病因の同定や悪性腫瘍の除外に役立っている。病歴は悪性腫瘍のリスク評価や運動障害とメカニカルプロセスの鑑別に役立つが、内視鏡検査は避けて通れない道である。様々な食道画像プロトコルを用いたX線検査は、はっきりしない症例の評価に有用である。しかし、この方法を最初の検査として用いることは、費用対効果が悪く、食道画像が陽性でも陰性でも内視鏡検査が必要となり、治療が遅れてしまう3.内視鏡検査は、原因不明の狭窄や炎症が疑われる場合に、狭窄の治療や生検を行う機会である。食道炎(逆流性食道炎、好酸球性食道炎(EoE)、ピル食道炎、扁平苔癬など)、狭窄・腫瘤、大きな裂孔ヘルニアを認めない患者には運動機能検査を行うべきである(図1)。標準的なアルゴリズムは、患者の症状を説明する運動障害を除外するために高分解能マノメトリー(HRM)を行い、症状の原因となっている運動異常に対して治療を行うというものである。このプロセスは、アカラシアとそのサブタイプを特定することに重点を置いており、精度の高い治療を提供することが可能である4。大きな運動異常のない患者さんでは、機能的嚥下障害が認められることが多く、神経調節薬や行動療法が行われます5。
図1. 
図1.
食道嚥下障害を呈した患者の治療アルゴリズム
嚥下障害の管理アルゴリズムはこの10年間で劇的に変化したわけではないが、インピーダンス技術や内視鏡的介入を用いた診断検査に大きな進歩があり、運動障害の病態に関しても興味深い観察がなされている。したがって、このレビューの目的は、これらの最近の進歩に焦点を当て、それらがどのように疾患過程の理解を向上させたかを議論することにある。嚥下障害を呈する可能性のある各疾患の完全な説明はこのレビューの範囲を超えており、代わりにこのアップデートは、これらの疾患の中で進化しつつある、我々の管理戦略を改善しうるいくつかの重要な落とし穴と概念に焦点を当てることになる。
診断名
内視鏡陰性嚥下障害における食道運動機能評価に焦点を当てた最も重要な技術はHRMである。この技術は10年以上前に導入されて以来、進化を続けており、この間、食道機能の分類体系やバイオマーカーに大きな変化があった。現在、食道運動機能障害の分類に用いられているのは、Chicago Classification(CC)6という分類法である。この分類法は、運動アーチファクトを低減し、圧痕をより直感的な圧力トポグラフィーに変換することにより、マノメトリック技術の向上に大きな影響を与えたが、この分類法を臨床で使用するには限界があり、もし認識されないと誤診や不適切な介入につながる可能性がある。CC 3.0では、収縮と加圧のパターンを記述することに重点を置き、食道の正常な前向性空洞化を促進する4つの特定の要素に基づいてこれらを分類しています。これらの構成要素は、従来のマノメトリーによってもともと概念化されていたものを反映していますが、嚥下時の食道胃接合部(EGJ)開口ダイナミクスをより正確に評価すること、脱腸抑制の観点から蠕動のタイミングをより適切に記述すること、収縮性圧力波によるボーラスの推進に関してより詳細に記述することに重点を置いています。統合弛緩圧(IRP)は、下部食道括約筋(LES)が閉じているときの接触圧とLESが開いているときの腔内圧によって生じるEGJを流れる抵抗力を測定することができます。遠位潜時(DL)インターバルは、移行部より下の平滑筋収縮のタイミングを測定することにより、脱腸抑制が損なわれていないかどうかを評価するものである。移行部の手前、あるいはその直後に起こる早期の収縮は、潜時間隔が4.5秒より短いとボーラスの分断(コークスクリュー食道、ロザリオビーズ食道)につながる。蠕動波の推進機能は食道が5cm以上の隙間なく、シームレスなアンテイグレード方向で管腔閉鎖を維持できる程度の強さで評価することができる。平滑筋の収縮の強さは遠位収縮積分(DCI)を用いて測定し、波面の完全性は20mmHg等圧線輪郭以下の蠕動運動途絶の測定値を用いて測定する。CCは、これらの新しい指標(IRP、DL、DCI、蠕動性断端)について、無症状対照者の正常上限を決定し、これを嚥下障害の大規模な患者集団に適用することによって作成されたものである。
シカゴ分類の限界
CCはマノメトリック技術を進歩させたが、このアプローチには限界があり、食道運動障害の診断に悪い影響を与える可能性がある。まず、この分類法はIRPの精度に大きく依存しており、この指標は位置やセンサー技術に依存するため気まぐれになることがある。したがって、食道胃接合部流出路閉塞(EGJOO)の診断には慎重な解釈が必要であり、この指標だけで介入を決定するべきではありません。さらに、CCはマノメトリー検査のメタデータを無視しており、それらは規範範囲データに基づき、たった10回の仰臥位嚥下を使用して作成されている。確かに、嚥下間または誘発操作中の痙性または非協調性収縮の証拠は、運動機能の解釈において考慮されるべきです。最後に、食道裂孔ヘルニアや外反圧迫などの解剖学的問題、EGJや食道壁での微妙な閉塞がCC診断に類似した運動パターンを作り出すことがあるので、無症状のコントロールで見られる以上の異常運動パターンは必ずしも真の一次運動障害と一致するわけではありません。
食道胃接合部流出障害
EGJOOは、進化したアカラシア、機械的閉塞、IRP測定に固有の問題に関連したアーチファクトを持つ患者からなる異質な診断群である。IRPの上昇は体位アーチファクトまたはカテーテルの極端な屈曲に関連するものであり、体位変換によりIRPは正常化することがある。したがって、このアーチファクトがEGJOOの診断に誤導していないかどうかを評価するために、仰臥位と立位の両方でIRPを測定することが極めて重要である7.HRMには、真の閉塞の可能性を高める補完的な所見がある。例えば、コンパートメント型の眼窩内圧の証拠、ボーラス通過性の悪さ、収縮亢進の併発である。しかし、これらの所見は流出閉塞を確認するのに十分な精度であるとは示されていない。バリウム錠を用いた時間差バリウム食道写真やEGJ開口部のFLIPパノメトリー評価など、他の検査が真の閉塞を確認する上で有用となりうる。これらの検査で真の閉塞を指摘されても、それが進化したアカラシアであるかどうかの判断は困難であり、困難かつ不明確な症例でアカラシア治療を検討する前にさらなる評価が必要な場合がある。断層撮影や内視鏡的超音波検査は有用であるが、機械的閉塞や偽性アカラシアの提示が疑われる場合(発症年齢が高い、体重減少が比例しない、内視鏡検査でEGJに異常がある)、嚥下困難で食道検査で明らかな閉塞が認められるEGJOO患者に限定すべきものである。
ジャックハンマー食道
EGJOOと同様、DCI値が8000mmHg*s*cm以上の嚥下が2回あることを基準に診断されるジャックハンマー食道は、非常に不均一な分類である。しかし、これらの基準を満たしたからといって、患者を侵襲的な治療に委ねるには十分な根拠がない。前述の通り、このパターンはEGJの閉塞と関連する可能性があり、胃食道逆流症(GERD)やEoEとの関連でもみられます。このような不均一性を考慮すると、筋切開術を行う前に、閉塞の除外と平滑筋弛緩剤の経験的投与に重点をおいた検査を行うべきである8。 Jackhammer食道と診断された患者の多くは、良性の経過をとる。特にGERDに対する手術前の検査で、このパターンが偶然に見つかった場合は、観察、経過観察も妥当であろう。現在のところ、閉塞性のジャックハンマー食道患者における真の一次運動機能障害と、嚥下阻害による反復性多峰性収縮や長時間のピーク後収縮などの特徴とを区別する基準はない。残念ながら、これらのパターンはいずれも、平滑筋収縮力の低下に焦点を当てた治療に反応する患者を決定するのに十分な予測値を持っていない。最近、原発性運動障害における円形筋の好酸球浸潤と炎症の役割に大きな関心が集まっており、診断のパラダイムにおいて、筋組織学のより積極的な評価につながる可能性がある9。
病態に関する知見の進展
好酸球性筋炎
EoEは嚥下障害の重要な病因のひとつであり、現在、米国における緊急の食物詰まりの第一の原因となっています10。この疾患は、食道壁の線維化とリモデリングを引き起こす慢性的な免疫/抗原介在性の好酸球性炎症反応と関連しています11。この患者群における嚥下障害の原因は、機械的な内腔の狭窄に関連していると考えられていますが、EoEが運動機能障害と関連していることを示す証拠もあります12。実際、EoEと診断された患者さんにおいて、コルチコステロイド治療後に古典的なアカラシアのパターンが消失したという症例報告も発表されています13。また、好酸球が粘膜を越えて食道の平滑筋に浸潤し、大きな運動障害を呈している患者さんがいるという証拠も出てきています14。アカラシアに焦点をあてた研究では、筋切開や食道切除の標本に好酸球性炎症性神経節炎が高率に認められたと報告されている。同様に、ケースシリーズでは、経口的内視鏡下筋切開術(POEM)を受けたジャックハンマー食道患者の生検から好酸球が高濃度に浸潤していることが報告されている15。これらの研究では、円形平滑筋内に神経毒性や細胞毒性を持つ好酸球由来の分泌物が存在することも報告されており、この発症メカニズムの生物学的な信憑性がさらに高まっている16, 17.これらの作用が正常な蠕動運動に関連する腸管ニューロンを標的にして破壊するか、あるいはこの炎症反応が収縮亢進を促進する他の因子を放出させることが考えられる。
上記のデータはこの興味深い仮説を間接的に支持しているに過ぎないが、アカラシアやジャックハンマー食道のステロイド療法を開始する前に、より多くの証拠が必要である。将来的には、これらの異常が本当に病原性であり、基礎疾患状態とは関係ないのかどうかを評価するために、前向きな研究を行う必要がある。
オピオイド食道
オピオイドが胃、小腸、大腸の運動性に及ぼす影響は文献で十分に説明されており、ほとんどの医師はオピオイドが便秘を引き起こし、腸の通過性を低下させることを理解している18。同様に、オピオイドは食道運動にも同様のメカニズムで影響を与えると考えられ、この効果については様々な薬理学的介入試験により研究されている19。1996年、Penaginiらはモルヒネとナロキソンの食道運動機能に対する影響について報告した20。その結果、嚥下時のLES残圧はオピオイドにより上昇し、LES弛緩時間および弛緩率は減少することが示唆された。さらに、蠕動運動速度は増加したが、収縮振幅の変化はごくわずかであった。これらの所見は、対照群に少し異なるプロトコルを用いた他の研究でも一貫して認められていることから、オピオイドは食道蠕動運動とLES弛緩の抑制成分を変化させる可能性があると思われる。さらに最近、Mayoの研究チームは、マノメトリー検査時にオピオイドを使用していた、あるいは検査の24時間以上前から使用していなかったオピオイド使用者121人におけるCC診断の有病率について報告した21。その結果、III型アカラシアとEGJOOの両方が、少なくとも24時間以上オピオイドを中止した患者と比較して、現在オピオイドを使用している患者でより一般的であることが判明した。
これらの結果は、オピオイドの使用は食道運動を変化させる可能性があり、食道マノメトリー検査を受けた患者において主要な運動障害の発生率が高くなる可能性があることを示唆している。これらの影響がオピオイドの使用中止により消失するか、オピオイド拮抗薬の投与により正常化するかは不明である。しかし、これらの悪影響を理解することは、オピオイドを使用している嚥下困難な患者を評価する際に重要である。
運動パターンの分類は、従来は収縮と加圧のパターンの評価に限られていたため、ボーラス通過と食道内腔径の評価にインピーダンス技術を取り入れることは、運動評価にとって自然な流れであった。さらに、初期のインピーダンス法は、ボーラス通過の単純な二項対立的評価であり、客観的および主観的な結果に関して、ほとんど識別情報を提供することができなかった。その後、HRMを補完する2つの新しい技術、高分解能インピーダンスマノメトリーとFLIPパノメトリーが登場した。
高分解能インピーダンスマノメトリー
インピーダンス評価は15年以上前からマノメトリと連動していましたが、嚥下障害に関連した食道機能検査にインピーダンスが与える影響はごくわずかでした。インピーダンスがHRMと融合し、HRMと同様の方向で構成されるようになって初めて、管腔内インピーダンス記録のインパクトが認識されたのである。この方法の初期のパイオニアはTaher Omariの研究室で、最初の研究は、小児患者の誤嚥の非放射線学的評価ツールとして、咽頭食道セグメントを横切るボーラス通過ダイナミクスを評価することに焦点を当てたものであった22.このグループは、このアプローチを成人集団と食道に進め、自動インピーダンスマノメトリー(AIM)プラットフォームを作成し、ボーラス膨張と同時に食道内圧のマーカーとしてインピーダンス信号に注目した新しい評価指標を開発した23。彼らはこれらの測定基準により、嚥下障害の症状を予測することができ、また症状のある機能性嚥下障害患者と噴門形成後の患者をよりよく識別できることを示すことができた24。他の研究者たちは、蠕動運動の抑制成分を評価するためにこの方法を改良しており、この方法はおそらくさらに進化して、体積流量の推定が可能になると思われる25。
これと並行して、Northwesternグループは、食道インピーダンス積分(EII)とボーラスフロー時間(BFT)を開発し、現在のインピーダンスマノメトリー併用アルゴリズムにより定量性を持たせる新しい技術の探求を始めた26, 27.EIIは、インピーダンスの低下が体積膨張に関連するという概念に着目し、嚥下波の時空間領域における累積インピーダンス信号の計算を開発することで導き出されました。この研究の結果、EIIは透視検査や簡易食道嚥下障害質問票の症状スコアと相関があり、これはCC28に使用した標準的なHRM指標より優れていることが示唆された。同様のアプローチでEGJに焦点を当て、研究者らはBFTをEGJ開口部の時間測定として概念化し、ベースラインの90%以上のインピーダンス低下をボーラス存在のマーカーとして用い、優先的な流量勾配が存在する時間を決定している。この指標はIRPやEGJ底部圧よりもボーラスの滞留や症状の予測に優れていた28。嚥下時の内腔形状を予測する上で、内腔インピーダンスの役割をより詳細に評価しようとする新しいアプローチも視野に入ってきている。
機能的内腔イメージプローブパノメトリー
FLIPパノメトリーは、インピーダンスプラニメトリーを応用したもので、高解像度の方向に構成されたセンサーを用いて、食道内腔の3次元画像を提供します29。内腔寸法のデータと圧力センサーを組み合わせることで、直径/体積の圧力変化を評価し、拡張性やコンプライアンスなどの食道の機械的特性を測定することができる。この技術は、標準的な上部内視鏡検査で患者を鎮静化した状態で実施される。この方法は、EGJの伸展性を評価することに重点を置いており、アカラシアや術後閉塞におけるEGJ機能に関する有用な補完的情報を提供することが示されている 30, 31.最近では、この技術を応用して、持続的な体積膨張に対する食道運動機能を評価することができるようになりました32。容積応答は二次的な拡張を介した収縮活動を誘発し、これは直径の測定値をカラートポグラフィーに変換し、時空間の直径変化を示すことで視覚化することが可能である。直径の減少は収縮を表し、これらの収縮はその方向と内腔を閉塞する能力に基づいて評価することができる。約6〜8秒間隔で繰り返し起こる前向きの収縮は、持続的な容積拡張に対する正常な反応と考えられ、このパターンはHRMにおける正常な蠕動と関連している(図2)。収縮は逆行性に起こることもあり、このパターンは痙性障害、EGJ閉塞、慢性オピオイドなどの状況下で見られるものである。収縮を誘発できない場合は、無蠕動や弱い蠕動に関連し、拡張や萎縮に関連する筋原性機能障害やトリガーの障害に関連する神経原性機能障害を表している可能性があります。これらのパターンと既に検証された EGJ 開口評価法を用いると、その反応パターンは CC と同様の運動性分類スキームに概念化できる(図 2)33.この装置は現在、嚥下障害の管理における補完的なツールとして使用されていますが、患者を鎮静化した状態で運動性とバイオメカニクスの両方の測定ができるというユニークな利点から、将来的には食道疾患の管理におけるより主流の診断ツールになる可能性があります。
図2. 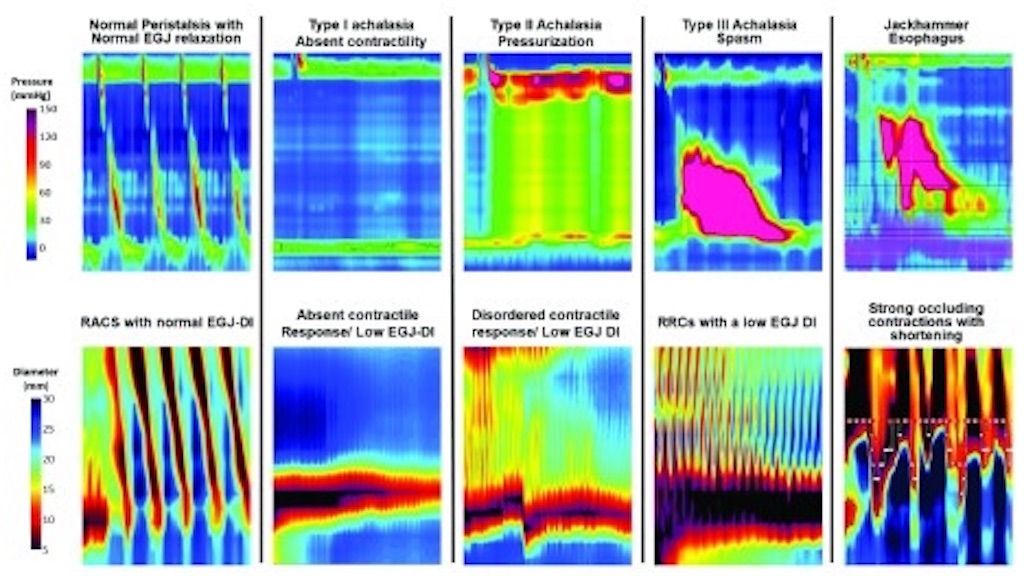
図2.
高解像度マノメトリーパターン(上)と対応する機能的管腔イメージングプローブのパノメトリーパターン(下)。
介入方法
口腔周囲食道筋切開術
過去10年間、粘膜下層用内視鏡は治療用内視鏡医の新たな武器として発展してきました。これらの技術により、POEMは、空気圧拡張術、腹腔鏡下ヘラー筋切開術と並んで、アカラシアの3大治療法の一つとして急速に採用されている34, 35.POEMは2007年にPasrichaらが胆道拡張バルーンを用いて粘膜下トンネルを形成し、その後ニードルナイフを用いて円形筋切開を行った動物モデルで紹介された36。2008年には、井上らがヒトで初めてPOEMを行い、アカラシアの治療として17例のケースシリーズを発表した37。POEMは合併症のないアカラシアに対して初めて行われたが、現在、正式な適応に関するコンセンサスはなく、アカラシア(3つの臨床サブタイプすべて)、非アカララシア性運動障害(遠位食道痙攣、EGJOO、ジャックハンマー食道)、アカラシアに対する過去のLES標的治療失敗後など様々な治療適応について研究が行われてきた38。この方法はまだ成熟していないが、90%以上の患者が臨床的な改善を報告しており、有望な成績である39, 40。
概要
嚥下障害の病態生理と基礎的メカニズムに関する我々の理解は、患者の評価と臨床的判断に用いる技術とともに進化し続けている。しかし、今のところ、内視鏡陰性嚥下障害における機械的閉塞や悪性腫瘍の除外、食道運動障害の診断には、引き続き内視鏡検査に頼っています。近い将来、FLIPのような新しいテクノロジーが運動性検査を内視鏡検査の指標とし、治療を迅速化し、患者の表現型を改善する可能性を持っている。また、HRMも進化しており、難しい境界例や痙性障害の判定に役立つと思われます。さらに、好酸球がEoE以外の食道運動障害にも真に関与しているとすれば、内視鏡的超音波検査や内視鏡的粘膜剥離術を用いた深部筋生検がより大きな役割を担うことになるかもしれない。このように、嚥下障害の管理は新しい技術と並行して急速に進化している。
日本の出生コホートにおける多動性/不注意および注意欠陥/多動性障害児の多遺伝子性リスクスコア
日本の出生コホートにおける多動性/不注意および注意欠陥/多動性障害児の多遺伝子性リスクスコア
高橋 長英, MD, PhD1; 奥村 明美, PhD2; 西村 智子, PhD2; et al 原田 妙子, PhD2; 岩渕 俊樹, PhD2; Md Shafiur Rahman, PhD2; 土屋 健二, MD, PhD2
著者名 所属記事情報
JAMA Netw Open.2022;5(1):e2141768. doi:10.1001/jamanetworkopen.2021.41768
はじめに
寄生虫、短い睡眠時間、睡眠の質の低下などの睡眠障害は一般的で、注意欠陥・多動性障害(ADHD)の子どもの20~50%に見られると報告されています1。睡眠障害は子どもの日中の過度の眠気を引き起こし、しばしばADHDの誤診につながります2。したがって、睡眠障害はADHDと慎重に区別し、ADHDの管理で評価する必要があります。注意欠陥・多動性障害は遺伝性が高いが、ADHDの遺伝的リスクと小児の睡眠問題との関連はまだ解明されていない。本研究では、日本の一般集団の8歳から9歳の子どもを対象に、睡眠問題とADHDの多遺伝子リスクスコア(ADHD-PRS)が多動性/不注意症状に関連するかどうかを検討した。
方法
このコホート研究は、浜松医科大学・大学病院倫理委員会の承認を受け、ヘルシンキ宣言に準拠して実施された。浜松母子コホート研究への乳児の参加については、各保護者から書面によるインフォームドコンセントを得た。本研究は、Strengthening the Reporting of Observational Studies in Epidemiology(STROBE)報告ガイドラインに従った。
浜松で実施中の「浜松母子健康手帳研究」の2007年12月と2011年6月に生まれた参加者は、睡眠パラメータと多動性/不注意症状を伴うADHD-PRSとの関連について試験を受けた。多動性/不注意症状は、日本語版注意欠陥/多動性障害評価尺度(ADHD-RS)を用いて測定された。睡眠時間、睡眠潜時、夜間覚醒(あり・なし)、入眠遅延(早い・遅い)の4つの睡眠パラメータを評価するために、乳児睡眠簡易調査票を使用した。睡眠開始は早期(午後10時以前)と遅延(午後10時以降)に分類された。
睡眠パラメータと多動性/不注意症状との関連を調べるために、構造方程式モデリングによる回帰分析を用いた。ADHDの遺伝的負荷が異なる子どもにおける睡眠パラメータと多動性/不注意症状の関連を調べるため、ADHDの遺伝的リスクに関するADHD-PRSの百分率を用いて、子どもを低(0~33%)、中(34~66%)、高(67~100%)の3群に分けた。また、構造方程式モデリングを用いた回帰分析により、各群における睡眠問題と多動性/不注意症状との関連を検討した。P値はBenjamini-Hochberg補正を用い、標準誤発見率5%で多重比較の補正を行った。ADHD-RSのパーセンタイルスコアの非正規性を補正するために、Satorra-Bentler補正を使用した。すべての統計解析はStata version 16.0 (StataCorp LLP)を用いて行った。
結果
8歳から9歳の835人(男子408人、女子427人)のデータを分析した。4つの睡眠パラメータのうち、入眠遅延のみが多動(係数[SE]、11.26[2.87]、P < .001)、不注意(係数[SE]、9.16[2.91]、P = .002)および総合症状(係数[SE]、9.83[3.17]、P = .002)に関連することがわかった(表)。ADHDの遺伝的リスクが低い群でのみ、入眠遅延は多動(係数[SE]、18.57[4.37];P<0.001)、不注意(係数[SE]、16.92[4.84];P<0.001)、および全身症状(係数[SE]、21.19[4.77];P<0.001)に関連していた。ADHDの遺伝的リスクが中・高の群では、入眠遅延とADHD-RSスコアとの関連は認められなかった(図)。

考察
本コホート研究において、入眠遅延は子どもの多動・不注意症状と有意に関連しており、これは先行研究4と一致していた。しかし、この関連はADHDの遺伝的リスクの低い子どもにおいてのみ明らかであった。本研究の限界は、ADHDの症状に対する参加者の薬物療法の使用に関する情報がないことである。
我々のデータは、ADHDの過剰診断を避けるために、睡眠習慣、特に入眠を評価することが不可欠であることを示唆しています。また、概日リズムの遅れが「遅発性ADHD」の原因である可能性があるという仮説も部分的に支持されました。5 最後に、我々のデータは、早期の入眠が子どもの閾値以下の多動・不注意症状を改善する可能性があることを示唆しています。
ASDのPb及び微量元素の評価
自閉スペクトラム症における尿中鉛(Pb)および必須微量元素の評価:マレーシアの就学前児童におけるケースコントロール研究
Mohd Shahrol Abd Wahilら、Biol Trace Elem Res、2022 Jan.
PMC無料論文
詳細を表示
全文リンク
引用元
概要
鉛(Pb)は環境中に豊富に存在する重金属であり、微量であっても小児に神経毒性を引き起こすことが知られている。しかし、微量元素のカルシウム(Ca)、マグネシウム(Mg)、亜鉛(Zn)、鉄(Fe)は神経発達の保護作用があり、子どもにとって不可欠である。本研究の第一の目的は、就学前児童の自閉症スペクトラム障害(ASD)の発達における鉛と微量元素の役割を評価することである。3歳から6歳のASD児81名と定型発達(TD)児74名が研究に参加した。自記式のオンライン質問票を保護者が記入した。朝一番の尿サンプルを無菌ポリテンの尿容器に採取し、誘導結合プラズマ質量分析計(ICP-MS)を用いて、Pb、Ca、Mg、Zn、Feを測定した。群間比較の結果、ASD児の尿中Pb、Mg、Zn、Fe濃度はTD児より有意に低いことがわかった。ASDのオッズは、尿中ZnとFeがそれぞれ1.0μg/dL増加するごとに、5.0%と23.0%有意に減少した。相互作用後の解析では、ZnとPbの尿中濃度が1.0μg/dL増加するごとに、ASDのオッズはそれぞれ11.0%と0.1%有意に減少した。ASD児の尿中Pb濃度がTD児より有意に低いのは、解毒機構が弱いためと思われる。また、ASD児の尿中ZnおよびFe濃度が有意に低いことは、Pbの神経毒性作用を増強している可能性がある。
キーワード自閉症、児童、鉛、微量元素、尿中.
はじめに
鉛(Pb)は、地殻中に存在する天然由来の非鉄重金属元素である。最も毒性の強い汚染物質の一つであるにもかかわらず、Pbはその可鍛性と耐腐食性により、世界中で様々な産業や消費者向け製品に使用されてきた[1]。現在の産業革命、急速な都市化、経済発展により、人間が鉛にさらされることは避けられない。鉛は、人体に対して強力かつ不可逆的な健康影響を及ぼすことは注目に値する。例えば、鉛は、極めて低濃度であっても、多くの疾患の潜在的な補因子、イニシエータ、プロモータとなりうる[2]。したがって、世界中の多くの国で、人間が頻繁に鉛にさらされることは、世界的な環境保健上の関心事となっている。ヒトは、鉛を経口摂取したり、鉛で汚染された土壌や粉塵を吸入することによって、鉛に曝露される可能性がある[3]。
幼い子どもは、独特の生理的特徴を持つため、大人よりも鉛の曝露に対して脆弱である。成人と比較して、子供の消化器官は経口摂取量 [3] と鉛の吸収率 [4] が高く、絶食時や必須微量元素の不足時にはさらに増加する可能性がある [5, 6]。さらに、幼児の口移し行動により、鉛に暴露される可能性がある [7]。幼児は、生来の好奇心と非食品と食物の区別がつかないために、しばしばピカ(非食品を食べたいという持続的かつ強迫的な欲求)の習慣がある [8]。消化器官は別として、鉛への暴露は、未成熟で発達途上にある子供の神経系に容易に害を及ぼす可能性がある[9]。
環境中には、鉛の採掘と精錬、鉛関連産業(特に電池と電子機器)、屋内外の鉛系塗料、水道管、はんだ、家庭用品(例:色鉛筆、クレヨン、鉛系塗料で塗装したおもちゃ、鉛釉の陶器、タバコ、鉛入りガソリン、化粧品、伝統療法)、鉛を含む趣味(例:釣り、絵画、電子機器の収集)等多くの鉛源候補がある [4, 10-14].鉛関連産業の労働者は、衣服、履物、皮膚、その他の身の回りのものについた鉛の粉塵を自宅に持ち帰ることにより、「持ち帰り汚染」の一因となる可能性がある [4, 15]。都市部に住む子供たちは、他の鉛汚染源(土壌や塵など)や人 為的活動(道路交通、産業、建設や解体など)によって生じる排出物 にさらされる可能性がある [2, 16]。これらは、環境内で急速に空気中を拡散し、食物連鎖を汚染し、最終的に人体に入る[17]。小児期の鉛曝露のその他の関連する危険因子は、両親の教育レベル、社会的地位、子供の行動、習慣、食事、栄養状態である[18]。
小児期の鉛中毒は予防可能な環境疾患であり、健康や行動に長期的な悪影響を及ぼす。鉛に曝された子どもは、神経系の不可逆的な形態的・分子的変化を経験しやすい[19-21]。鉛の毒性は中枢神経機能に様々な悪影響を及ぼすことがよく知られている。その結果、これらの影響は、広範な発達遅延、知的・行動的障害、多動性、社会的引きこもり、粗大・微細運動能力障害、知能指数(IQ)低下のリスクを増大させる [22-27]。さらに、これらの影響は、出生後数時間以内の高い鉛濃度と関連している[28]。
多くの先進国では、鉛を規制し管理するための政府の法律や法整備が有効であるため、現在では小児に急性高濃度の鉛中毒が起こることはほとんどない[29]。これらの制御手段の例は、ガソリンや家庭用塗料に含まれる鉛の段階的廃止や、産業排出物、水中鉛などの削減である[29]。しかし、慢性的な低鉛毒性濃度も同様に心配され、子供たちに多く見られる[30]。血中鉛濃度(BLL)が10.0μg/dL以下の子供では、数多くの神経認知および神経行動学的な影響が観察された[31-36]。米国疾病管理予防センター(CDC)は当初、BLLの上昇を10.0μg/dL以上と定義した[37, 38]。しかし、その後、CDCは2012年にその値を5.0μg/dLに引き下げました[39, 40]。カットオフBLL濃度にかかわらず、子どもの進行性の神経発達に悪影響を及ぼすため、どの鉛レベルも安全と見なすことはできない[41, 42]。
自閉症スペクトラム障害(ASD)は、アメリカ精神医学会の『精神障害の診断と統計マニュアル第5版』(DSM-5)に記載されているように、さまざまな神経発達障害を説明するものである[43]。社会的行動の異常、コミュニケーションや相互作用への無関心、言語障害、反復的で強迫的な行動、狭い焦点の硬直した興味によって特徴付けられる[44]。1943年に10,000人の子どもあたり4.5例の有病率で初めて記述されて以来[45]、ASDの有病率は大きく増加している[46-50]。ASDの原因および病因については、依然として議論の余地がある。現在、コンセンサスが得られていないため、様々な生物医学分野の研究者がASDの複数の可能性のある原因を研究している。
ASDの発症に環境因子(神経毒性重金属への曝露など)が果たす役割は見過ごせない。ASDの広いスペクトラムは、この疾患の表現型の不均一性が、主として遺伝的障害に起因するのではなく、特定の環境因子への曝露に起因する可能性をも示唆している[51]。神経毒性および重金属(Pbを含む)曝露は、神経発達障害の原因と関連している[52]。これまでの研究では、Pbは発達中のヒトの脳に損傷を与え、広範な神経発達障害を引き起こすと報告されている [25、36、53]。線量毒性のレベルに応じて、障害は明白な臨床症状(高用量毒性)から不顕性機能障害(低用量慢性毒性)に及ぶ可能性がある [25、36、53]。
カルシウム(Ca)、マグネシウム(Mg)、亜鉛(Zn)および鉄(Fe)を含む必須微量元素は、子供の正常な脳の発達、神経伝達物質合成の異化、細胞代謝過程、神経伝達物質に関連する代謝および運動発達に重要な役割を果たす[54-60]。したがって、これらの元素のレベルの変化やそのアンバランスは、神経伝達物質の機能不全につながる可能性がある。神経伝達物質の機能障害は、神経疾患や行動障害を含む多くの病状や疾患において観察されている[61-63]。しかし、ASD発症におけるこれらの元素の役割についてはあまり知られていない。ASDでは必須微量元素が興奮性シナプスと抑制性シナプスを機能不全に陥らせたことが示唆されている[64]。
主にCaは神経発達に重要であり、シナプスの発達と機能を調節することでASDの予防と治療効果をもたらす可能性がある[65]。Caはしばしば標的タンパク質と迅速に結合し、その後Caチャネルの機能を調節し、Caシグナルを発生させる[66-68]。Mgは、γ-アミノ酪酸(GABA)シグナルを調節する体内で4番目に調節的な陽イオンである[69, 70]。また、Mgは銅-亜鉛スーパーオキシドジスムターゼ(CuZn-SOD)および細胞から放出される一酸化窒素を活性化する[71]。CuZn-SODと一酸化窒素は、脳の発達と機能的な幸福に重要である[71]。Znは興奮性シナプスに関連するPro-SAP/Shankタンパク質の足場として必要であり、Zn濃度の低さはASDと関連している[72]。一方、FeはDNA合成、遺伝子発現、髄鞘形成、神経伝達、ミトコンドリア電子輸送に必須な元素である[73]。これらの機能は中枢神経系にとって極めて重要である。したがって、Feの欠乏は、脳における神経伝達プロセス、ミエリン形成、エネルギー代謝を損ない、これが小児の行動および認知発達の遅れを引き起こすと考えられた[74, 75]。
乳製品や粉ミルクを定期的に摂取することは、子どもの健康に有益である[76]。これらの食品は、Caを中心とする微量栄養素を多量に摂取できる高い栄養価を有している[76]。しかし、Caの過剰摂取は、腎石症、ミルクアルカリ症候群を引き起こし、Mg、Zn、Feなどの他の必須微量元素の吸収を阻害する可能性がある[77]。Mgは、葉野菜、豆類、ナッツ類、種子類、全粒穀物、動物性食品、飲料に広く分布している[77]。Zn源は、タンパク質が豊富な植物(例えば、穀物や豆類)及び動物性タンパク質食品のいずれかに含まれる[78]。フィチン酸塩(例:全粒穀物、豆類、ナッツ類、種子類)と食事性CaはZn吸収を阻害し、タンパク質はZn吸収を促進することが知られていた[77]。Feの主な食事源は3つある:(i)母乳(Feがラクトフェリンと結合している)、(ii)ヘムFe(肉、鶏肉、魚)、(iii)非ヘムFe(例えば、ほうれん草、レンコン、カボチャ種子、豆、ナット、強化穀物) [79].非ヘム鉄の吸収は、アスコルビン酸や有機酸(例:肉、鶏肉、魚介類)、発酵野菜、発酵醤油などの鉄吸収促進因子と鉄吸収阻害因子(例:フィチン酸やイノシトールリン酸、鉄結合ポリフェノール、カルシウム、大豆タンパク質、野菜タンパク質)のトータルネット効果によって決まる [77].
マレーシアの都市部では、鉛の曝露は一般的である。2000年には、10.0μg/dLを超えるBLLを持つ子どもの有病率は、クアラルンプールの都市部で11.7%であった[80]。2015年の研究では,マラッカ都市部の子どもの27.0%が10.0μg/dLを超える血中鉛値を有していたことが明らかにされた[81]。クアラルンプール連邦直轄領はマレーシアの首都であり、国内で最も人口の多い都市地域を形成している。それは、この都市のますます高まるグローバルな志向と、より広い都市地域に対するその意味合いである[82]。市の総面積は243.70 km2 (24,221.05 ha)で、百パーセント市街地である。2005年の人口は1,556,200人であり、平均人口密度は1ヘクタールあたり64人であった[83]。2018年には1,790,000人に増加した[84]。クアラルンプールの急速な都市化によって環境汚染が進み,子どもたちは神経毒性のある重金属,特にPbにさらされる。したがって、クアラルンプールはこの研究を実施するのに最も適切な場所であった。我々の知る限り、マレーシアの就学前児童におけるASDの尿中鉛と必須微量元素を評価した研究はない。そこで本研究では、マレーシアの就学前児童のASD発症におけるPbと必須微量元素の役割を評価することを主目的とした。
方法論
今回の研究プロトコルは、マレーシア国立大学(UKM)研究倫理委員会およびマレーシア保健省(MOH)医学研究倫理委員会の承認を得ている。すべての手順は、ヘルシンキ宣言(1964年)およびその後の改訂版の原則に従って行われた。参加は任意であり、研究前に両親または法的な世話人からインフォームド・コンセントを文書で得た。この観察型アンマッチ症例対照研究は、2020年1月15日から3月15日まで、クアラルンプールの未就学児を対象に実施された。本研究は、マレーシアにおけるCOVID-19のアウトブレイクによる最初のMovement Control Order(MCO)前に完了した。
ASD児81名、定型発達児(TD)74名の計8名が登録されました。すべての子どもは、3歳から6歳のマレーシア国民である。両グループとも、学校の許可を得て、生徒の名簿から無作為に選ばれた。ASD児は、クアラルンプールのセントゥール市にある国立自閉症リハビリテーションセンター(GENIUS KURNIA)から採用された。このセンターはマレーシア教育省(MOE)により管理されている。ASDの臨床診断は、政府の三次病院に勤務する小児科医によって行われた。診断はDSM-5の基準と国際疾病分類-10(ICD-10)に基づいて行われた。対照群のTD児は、公立幼稚園(4~6歳)、すなわちTABIKA Department of Community Development(KEMAS)および公立保育園(2~4歳)、すなわちTASKA KEMASから募集された。プリスクールと保育園は、クアラルンプールのセントゥール市に位置している。
この2つの施設は、農村開発省(MRD)傘下の幼児教育部門によって設立・運営されています。これらの施設は、MOE(MOE under the National Preschool Standard Curriculum)、National Early Childhood Care and Development Policy、National PERMATA Curriculum [85]に基づいて運営されている。TD児は「健康」であると宣言された。彼らは,M-CHAT(Modified Checklist for Autism in Toddlers)スクリーニングと生後18ヶ月と36ヶ月のフォローアップ時の通常の子どもの健康評価に基づいて小児科医が検証したように,ASDの既知の特徴を持たなかった。両群とも、以下の除外基準を用いた。(i) 先天性異常または症候群、(ii) 神経発達障害または神経行動障害、(iii) 内分泌障害、(iv) 急性の感染症、外科的疾患、外傷性疾患、(v) 現在専門家が処方する定期内服薬または輸液薬(化学療法)、重金属除去用のキレート療法を行っている。
研究者は、電話、メッセージ、電子メールを通じて、各参加者の親(父親または母親)に、自記式のオンラインアンケート(Googleフォーム)に回答するよう通知した。本研究では、いくつかの理由から、オンラインで情報を収集するこの方法が好まれた。(i) 電話やコンピュータから簡単にアクセスできる、(ii) ユーザフレンドリー、(iii) いつでもできる(特に日中忙しい共働きの親にとって)、(iv) データ管理がしやすい(例:記録の保存、機密性、データ分析)、(v) マレーシアで発生したCOVID-19の集団感染の際に閉鎖接触を通じたCOVID-19感染の危険性に対する予防措置、などである。研究者は,質問票の記入が困難な保護者に対して,電話,メッセージ,電子メールを通じて支援した.質問票は、親子の社会・人口統計的背景、子どもの発達段階、ASDの素因を示す危険因子(妊娠合併症、早産、授乳、自閉症の家族歴など)、鉛への環境曝露、鉛に関する親の知識評価、子どもの食事パターンに関する情報を引き出すよう設計されていた。子どもの身体測定パラメータ(身長、体重など)は、身長測定台が付属した校正済みのデジタル体重計(オムロン社製)を用いて測定した。教室にいる研究者が測定値を記録した。
朝一番の尿は、20.0%の硝酸溶液で前処理した滅菌ポリテンの尿容器に、保護者が自宅で採取し、脱イオン水で2回すすぎました。実験に先立ち、親は研究者から尿サンプルの正しい採取方法についてアドバイスを受けた。(i) 採尿は清潔なキャッチボールであること (ii) 採尿量は5.0~10.0 mLであること (iii) 滅菌ポリテンの尿容器は洗剤、ボディソープ、その他の異物で汚染されていないこと (iv) 希釈効果を避けるために尿サンプルに水を加えないこと (v) 尿容器とバイオハザードのジッパーバッグを適切に閉めること。子どもたちは、通常通り食べ物や飲み物を摂取することができた。尿サンプルは、保護者が子供を自閉症リハビリテーションセンター、幼稚園、保育園に送っている間に、当日研究者に届けられた。尿サンプルはコード番号でラベル付けされ、24時間以内にセランゴール州バンギのUKM科学技術学部にある公認環境研究所に搬入された。
実験室では、0.2%硝酸(HNO3)溶液10.0 mLに尿サンプル1.0 mLを1:10の割合で加えて尿サンプルを調製した。この調製作業は、尿サンプルに含まれる有機物の消化過程を可能にするために不可欠であった。次に、調製した尿サンプルを、PerkinElmer SCIEX™ ELAN® 9000 誘導結合プラズマ質量分析計 (ICP-MS; PerkinElmer Inc., Shelton, CT 06484, USA) を用いて Pb およびその他の必須微量元素 (Ca, Mg, Zn および Fe) を分析した。この操作系を用いた各元素の検出限界は以下の通りである。Pb 1.0-10.0 part per trillion (ppt), Ca 10.0-100.0 ppt, Mg 1.0-10.0 ppt, Zn 1.0-10.0 ppt, Fe 1.0-10.0 ppt.Universal Data Acquisition Standards Kit (Perkin Elmer Inc., Shelton, CT 06484, USA) で調製した標準溶液を用いてシステムの校正を行った。内部オンライン標準化は、イットリウムとロジウムの10.0 μg/L溶液 Pure Single-Element Standard (Perkin Elmer Inc., Shelton, CT 06484, USA) [86] を用いて、マトリックス粘度の違いを評価するために実施した。
アンケートと実験室のICP-MSの結果のデータセットは、IBM Statistical Package for Social Sciences (SPSS) ソフトウェア(バージョン22、IBM、シカゴ、IL、米国)を使って分析された。統計解析の前に、データの正規性をグラフ(ヒストグラムとQ-Qプロットに基づく)および統計(歪度、尖度、Shapiro-Wilks/Kolmogorov-Smirnov統計に基づく)的に検討した。各参加者の人口統計学的パラメータについて頻度とパーセンテージを算出した。鉛レベル(平均±標準偏差)および他の必須微量元素(Ca、Mg、Zn、Fe)のグループ差は、スチューデントのt検定(正規分布の場合)またはMann-Whitney U検定(非正規分布の場合)を用いて評価された。潜在的な関連危険因子と交絡因子(量的変数)も、上記の2つの方法のいずれかを用いて評価した。また、記述統計として、分析した要素の中央値、四分位範囲(IQR)、最小値、最大値を使用した。カテゴリー変数はカイ二乗検定を用い、頻度と生率で表示した。尿中の元素濃度間の相関の大きさは、ピアソン相関検定(正規分布の場合)およびスピアマン順位相関検定(非正規分布検定の場合)を用いて分析された。測定元素の精度を評価し、元素のカットオフ点を選択するための包括的なツールとして、受信者動作特性(ROC)分析を実施した。ASDに関連する因子(独立変数には重金属、Pbを含む)を評価するために、単純ロジスティック回帰分析および重回帰分析を実施した。最終的な予測モデルは、要因の効果(オッズ比)を推定することを可能にした。本研究では、p値0.05未満を統計的に有意とみなした。
結果
図11にASD児とTD児の尿中鉛濃度レベルと必須微量元素(Ca, Mg, Zn, Fe)の年齢(月齢)別比較を示す。元素の濃度レベルのデータは正規分布していなかった。そこで、ノンパラメトリック検定を用いて、必須微量元素のデータを解析した。外れ値は保持し、真の所見を保持するために対数変換は行わなかった。ASD児とTD児の一般的な特徴を表1に示す。

図1
ASD児とTD児の尿中鉛と必須微量元素(Ca, Mg, Zn, Fe)の濃度を月齢で比較した。線は濃度の95.0%信頼区間(CI)を表す。

本調査における回答者の特徴および各変数の尿中鉛濃度について
合計155名の未就学児(ASD児81名、TD児74名)が研究に参加した。男女比は、ASD児が約5:1、TD児が約1:1であった(p<0.001)。両群の子どものほとんどがマレー人であった。ASD児とTD児のマレー人比率は、それぞれ75.0%と94.6%であった(p=0.003)。ASDであるにもかかわらず、3歳の時点で話すことができたASD児は約17.3%であった。一方、TD児は、話すことができることが対照群の対象基準の一つであったため、全員(100.0%)が3歳の時点で話すことができた。
ASD児の親はTD児の親より約1歳年上であった(p=0.047)。各群の親の年齢はほとんどが30歳以上であり(p < 0.001)、受胎時の親の年齢の代理が適切であることが示された。ASD児の半数以上が第一子であったのに対し、TD児の約30.0%は第二子であった(p<0.001)。ほとんどの親が中等教育を受けており(p<0.001)、B40所得層(月5000.00RM以下)であった(p<0.001)。
ASD児の大多数はクアラルンプール郊外、主にセランゴール州に住んでいた。一方、TD児の多くはクアラルンプールに住んでいた(p<0.001)。ASD児の出生地は公立病院(51.9%)、クアラルンプール市外(63.0%)であった(p<0.001)。一方、TD児の多くは、クアラルンプール市内(56.8%)の公立病院(85.1%)で生まれた(p=0.014)。ASD児の多くは中層住宅(テラスハウス32.1%,コンドミニアム32.1%)に滞在していたが,TD児の多くは平屋(54.1%)に滞在していた。家屋は,ASD群(22.28±14.62年)ではTD児(18.28±9.78年)に比べ古かった(p=0.045)。
保護者の多くは非喫煙者であった(ASD児群65.4%、TD児群81.1%)(p=0.011)。保護者は職場における鉛のリスクはないと主張した(ASD児群93.8%、TD児群82.4%)(p=0.027)。親の性別、子どもの年齢、子どもの予防接種状況、子どもの BMI、家族の ASD、産科的危険因子、家の位置(幹線道路、工場、建設現場の近く)、飲料水の供給源について、群間で有意差はなかった(p>0.05)。しかし,ASD児では出生地(p=0.046),授乳期間(p=0.013),TD児では家の建設現場への近さ(p=0.038)で尿中Pb濃度の群間平均に有意差がみられた.
図に示すようにFig.22 and Table Table2,2のように、尿中鉛と必須微量元素の実験室分析では、Ca(p = 0.096)を除いて、群間で統計的に有意な差が認められた(p < 0.05)。驚くべきことに、ASD児の尿中Pb濃度はTD児(平均0.58±0.41μg/dL)に比べ有意に低かった(p<0.05)。また、尿中のMg、Zn、FeもTD児に比べASD児の方が低かった。さらに、すべての男子児童と4歳以上の児童について評価を行った。その結果、すべての元素で同様の傾向がみられた。しかし、元素の平均値には、グループ間で顕著な差が見られた。4歳以下では、ASD児の方がTD児よりもすべての項目で高かった。しかし、Ca(p=0.002)を除いて、統計的に有意な結果は得られていない(p>0.05)。

箱ひげ図は、ASD児とTD児の尿中鉛と必須微量元素(Ca、Mg、Zn、Fe)の平均濃度を、全参加者、男子児童、女子児童の間で比較したものである。

ASD群とTD群の尿中鉛と必須微量元素濃度について
Table Table3,3に示すように、全体的な相関分析では、尿中鉛とCaを除く必須微量元素との間に有意な正の相関が示された(r = -0.01, p > 0.05)。この相関関係で示された関連レベルは、非常に弱いもの(Pb × Mg, r = 0.19)から中程度(Pb × Zn, r = 0.44)の範囲であった。必須微量元素間の相関は,弱い相関(Ca × Zn, r = 0.25)から非常に強い相関(Ca × Fe, r = 0.87)までの有意な正の相関を示した。同様の傾向は、すべての男子児童(n = 107)および4歳以上の児童(n = 140)において認められた。ASD児およびTD児群では,相関分析の結果,尿中鉛と必須微量元素との間には,男子ASD児(n = 68)のPb × Zn(r = 0.26,p > 0.05)を除き,有意な正の相関が認められなかった。

ASD群とTD群の尿中の調査元素レベルの相関関係
必須微量元素間の全体的な相関は、弱い相関(Ca × Zn、r = 0.25)から非常に強い相関(Ca × Fe、r = 0.87)まであり、有意な正の相関があることがわかった。同様の傾向は、男子児童全員(n=107)、4歳以上児童全員(n=140)、ASD児童全員(n=81)、男子ASD児童(n=68)、4歳以上ASD児童(n=76)にも認められた。必須微量元素の相関は,全TD児(n=74)および4歳以上のTD児(n=64)で中程度から非常に良い相関を示し,男性TD児(n=39)では優れた相関を示した.尿中CaとFeの相関は、異なるグループ間で良好から良好な相関が持続した(相関係数、rは0.64から0.97)。尿中PbとCaの相関は,有意ではないが,全児童(n=155),男性ASD児(n=68),4歳以下ASD児(n=5),女性TD児(n=35),4歳以下TD児(n=10)で負の非常に弱い〜弱い相関を示した.
表Table44は、ROC曲線分析を用いて、155人の子供たちの各尿成分のカットオフ点を示したものである。尿中PbとZnの曲線下面積は、1に最も近い有意な値を示した(それぞれ0.84と0.81)。一方,尿中 Ca,Mg,Fe は 0.5 に最も近い値を示した(それぞれ 0.57,0.59,0.65).すべての元素のカットオフ値は標準基準値の範囲内であった。

ROC曲線解析による155人の尿中成分のカットオフ値の決定と標準的な文献との比較
表Table55は、両群におけるASDの潜在的関連因子の多重ロジスティック回帰分析結果である。親の学歴、子どもの民族性、子どもの性別、親の喫煙状況がASDの有意な関連因子として同定された。第三次教育を受けた親は、中等教育を受けた親と比較して、ASD児を持つ確率が26倍であった(OR = 26.15, 95% CI 7.10, 96.38, p < 0.001)。非マレー人の子どものASDのオッズは、マレー人の子どもに比べて7.5倍高かった(OR = 7.52, 95% CI 1.62, 34.85, p = 0.010)。男性の子どものASDのオッズは、女性の子どもの8.5倍であった(OR = 8.52, 95% CI 2.76, 26.28, p < 0.001).元喫煙者の親は、非喫煙者の親と比較して、ASD児を持つ確率が25倍であった(OR = 25.29, 95% CI 4.03, 158.68, p = 0.001)。

ASDの関連因子の多重ロジスティック回帰分析結果
Table Table66 は、尿中 Pb と必須微量元素の多重ロジスティック回帰分析結果である。尿中PbとCa、PbとMg、PbとZn、PbとFeの交互作用は有意であった。したがって、これらの交互作用も多重ロジスティック回帰分析に含めた。さらに相互作用を解析した結果、尿中Pbが1.0μg/dL増加するごとにASDのオッズは0.1%有意に減少した(OR = 0.001, 95% CI 0.00, 0.89, p = 0.046 )。ASDのオッズは、尿中Caが1.0μg/dL増加するごとに24.0%有意に増加した(OR = 1.24, 95% CI 1.13, 1.36, p < 0.001).さらに交互作用を解析したところ、ASDのオッズは尿中Caが1.0μg/dL増加するごとに4.0%だけ増加した。しかし、この結果は有意ではなかった(OR = 1.24, 95% CI 1.13, 1.36, p < 0.001)。尿中Znが1.0μg/dL増加するごとに、ASDのオッズは5.0%減少した(OR = 0.95, 95% CI 0.91, 0.99, p = 0.008)。しかし、さらに交互作用を解析したところ、尿中Znが1.0μg/dL増加するごとにASDのオッズは11.0%有意に減少した(OR = 0.89, 95% CI 0.83, 0.93, p = 0.001)。尿中Feが1.0μg/dL増加するごとに、ASDのオッズは23.0%減少した(OR = 0.77, 95% CI 0.69, 0.87, p <0.001).また、尿中鉄濃度が1.0μg/dL増加するごとにASDのオッズは5.0%減少した。しかし、この結果は有意ではなかった(OR = 0.95, 95% CI 0.73, 1.24, p = 0.698)。

尿中Pbと必須微量元素の多重ロジスティック回帰分析結果
ディスカッション
Pbの体内負担を評価するバイオモニターとしての尿中Pb
尿中の鉛の定量は、血漿から拡散し、腎臓を通して排泄された吸収された鉛を反映していると考えられ、全排泄量の約3分の2を占める[87, 88]。尿中鉛は、過去数日から数週間以内の鉛曝露を反映していると理解されている [88, 89]。また、長期にわたる鉛の被曝の可能性も説明できる [87, 90]。血液から吸収された鉛は石灰化した組織(例:骨)に沈着し、何十年も貯蔵されることがある [91, 92]。Pbは、年齢や被ばく強度に応じて、骨の回転速度に基づき、コンパクト構造(回転速度が遅い)または海綿状構造(回転速度が速い)[92]から、石灰化組織からゆっくりと放出される[93]。加えて、幼児の継続的な成長は、骨格形成のための絶え間ない骨リモデリングを示している。この絶え間ない骨のリモデリングは、骨に蓄積された鉛が血漿中に継続的に放出される内因性汚染に寄与する [92, 94]。皮質骨は海綿骨に比べ、1日に尿中に排泄される鉛の濃度が約2倍以上である[95]。
24 時間採尿法は、多くの臨床研究で頻繁に使用されているが、限界がある。その限界とは、この方法が不便であることと、尿試料が重金属で汚染される可能性があることである [96]。いくつかの研究者は、短時間の採尿で鉛の排泄について十分な情報が得られることを示唆した[97]。例えば、Gulson らは、鉛の同位体組成について、血液と尿のペアには極めて良い相関があることを明らかにし、特に新生児や幼児においては、尿が血液の代替となり得ることを示した[96]。福井らは、尿中鉛は、クレアチニン濃度によって調整されない、集団ベースの血液中鉛測定に代わる良い方法であることを示唆した[98]。本研究では、子どもを対象としたバイオモニタリング研究において最も一般的で好ましい生体試料である尿のスポット採取をPb測定のために選択した。非侵襲的な試料(例えば、血液)は、臨床的な手順は、幼児に実行することが困難であり、親の不安を作成し、少ない参加と潜在的に選択バイアスにつながる可能性があるので、侵略的な試料(例えば、尿)の代わりに収集された[99, 100]。
鉛の濃度が上昇レベル以下であること
本調査の両群の尿中鉛濃度は、上昇値である 5.0 μg/dL 以下であった。尿中鉛濃度の最高値は2.5μg/dLであった。155人の参加者のうち、ほとんどの子供(90.0%)は尿中鉛濃度が1.0μg/dL以下であった(n = 135)。これまで蓄積されたデータ(1990年代初頭以降)は、低濃度レベルで発生する鉛の毒性について十分な証拠を提供している[101]。子どもは鉛への曝露に対してより脆弱であり、神経発達障害に苦しむ可能性が高いので、幼い子どもにおける健康への悪影響の重要性は過小評価できない[102]。以前のコホート研究では、BLLが10.0μg/dL未満の子どものほとんど、またはすべてにおいて有意な逆相関が示され [36、103、104]、他のコホート研究では1.0-2.0μg/dLと低かった[105-107]。利用可能な証拠は、米国およびヨーロッパ諸国における平均BLLが2.0〜4.0μg/dLであることを示唆している[108]。我々の研究は,ROC曲線解析から尿中鉛の0.25μg/dLという有意なカットオフ点を示し,このレベルでは鉛の神経毒性作用の可能性を示している。しかし,特に幼児において神経学的影響を引き起こす最低レベルは,今回の知見から結論づけることはできない。
本研究のすべての子供たちの尿中鉛濃度が低いことは、クアラルンプール都市部での鉛曝露が改善されたことを反映している可能性がある。クアラルンプール都市部で行われた以前の研究では、2000年に5.26μg/dL(BLLs)だった小児のPb濃度が[80]、2007年には3.40μg/dL(BLLs)と減少傾向にあることが示された[109]。今回の調査では、さらにPb濃度は0.42μg/dL(尿中Pb)まで低下している。尿中の鉛濃度は血液中の鉛に比べて一般に最低10倍低いので、これらの研究では異なる生体試料が用いられたが、この比較は有効である[88]。
20年以上にわたってマレーシアの子供たちの鉛濃度が低い理由は、マレーシア政府が1998年初頭からガソリンから鉛を段階的に排除するという行動をとったためであると考えられる[110]。その結果、大気中の鉛濃度は1990年から2004年にかけて大きく減少した[111]。マレーシア政府は、最新の国家自動車政策(NAP)2020 [112]を含む一連の政策を策定し、代替自動車の利用を奨励している。その例として,バッテリー電気自動車(BEV)や公共交通機関(電気バス,モノレール,電気鉄道など)が挙げられる.さらに、マレーシアは2014年から陶磁器製品に含まれる重金属(Pbを含む)の規制を計画していた。しかし,2020年にマレーシアは,検査中の調理器具のPbの最大放出量について,世界貿易機関(WTO)に新しい基準値である0.5mg/Lに通知した[113]。この新しい基準は,調理に使用される包装,器具容器,容器からの浸出液中のPbは2.0mg/Lを超えてはならないとした1985年の食品規制の13番目のスケジュールに取って代わった[114]。
マレーシア国内貿易・協同組合・消費者省(MDTCC)は、14 歳未満の子供を対象とした玩具の安全基準を 強制的に規制している。塗料中の鉛の最大許容移動量は、90.0ppmを超えてはならない[115]。マレーシアは、国内のE-waste分野全般を管理するための現地法の枠組みも導入している。これらの枠組みには、マレーシアで予定されている廃棄物や e-waste 管理に関連する法律や立法に基づく、発生、移動、リサイクル、廃棄が含まれる。これらの法律や立法には、環境品質法(EQA)1974、環境品質(規定施設)(予定廃棄物処理・処分施設)規則1989、環境品質(規定施設)(予定廃棄物処理・処分施設)命令1989、環境品質(予定廃棄物)規則2005、税関(輸入禁止)命令2012、税関(輸出禁止)命令2017が含まれます[116]。
ASD児の尿中鉛濃度の低下
今回の結果は、クアラルンプール都市部の就学前児童において、尿中の鉛が多いことがASDと関連するという初期の仮説を支持するものではなかった。むしろ、ASD児の尿サンプルのPb濃度はTD児より有意に低かった(ASD児0.26μg/dLに対してTD児0.58μg/dL)。年齢や性別などの潜在的な交絡因子を調整した場合(表2)2)、ASD児の尿中鉛濃度がTD児より高いことを示す十分な根拠は得られなかった。
しかし、私たちの一変量結果は、1980年代初頭から2020年までの他のいくつかの研究と一致している。これらの研究では、表7.7に示すように、ASD児の尿中Pb濃度はTD児より低いと報告されている。例えば,Marloweらは,人種や社会階層をマッチさせたTD児(平均6.66±2.49ppm)に比べ,ASD児の毛髪サンプルのPb濃度は有意に低い(平均6.28±2.12ppm)ことを報告している[118]。日本では,安田らがASD児の毛髪試料中の鉛濃度を,年齢・性別をマッチさせたTD児(平均0.89±0.50ppb)と比較して有意に低いことを報告している[119]。トルコでは,YorbikらがASD児の尿サンプル中の鉛濃度が,非対照のTD児(平均4.63μg/gクレアチニン)に比べ,有意に低いことを報告している[122]。サウジアラビアでは,アラブダリらが,年齢・性別をマッチさせたTD児(平均6.79μg/dL)に比べてASD児(平均4.73μg/dL)の血液サンプルのPb濃度が有意に低いと報告している[126]。ジャマイカでは,Rahbarらが,ASD児の血液サンプルの鉛濃度が,年齢と性別をマッチさせたTD児(平均2.73μg/dL)に比べ,有意に低いことを報告した[127]。その5年後、同じ著者(Rahbarら)は、ASD児の血液サンプルのPb濃度が、年齢と性別をマッチさせたTD児(幾何平均2.34μg/dL)に比べ、有意に低いことを報告した[131]。

同様の結果(ASD児のPb濃度が対照群に比べて低下)を示した先行研究のリスト
ASD児の鉛の排泄メカニズムの悪さ
本研究の結果は,ASD児はTD児に比べて重金属(Pbを含む)の排泄能力が低く,解毒能力が低いと考えられるという価値観も支持しており,これまでの証拠[132, 133]からも支持されるものであった。重金属の排泄能力の低下は,より高い体内負担とその後の神経学的障害をもたらすかもしれない[121, 134]。ASD児が重金属(Pbを含む)の排泄を困難にした理由は不明であり,十分に説明されていない。しかし,特異的な抗酸化物質の存在や,排泄の際のCaとPbの競合メカニズムによって,Pbの排泄の悪さを説明できるのではないかと推測される。
環境負荷に反応する酸化ストレスは、基本的に人間のあらゆる疾病に関与している。ASDの病因にも関与していると推定され、ASDにおける抗酸化能の低下と酸化ストレスの増大は、神経構造の損傷と神経機能の低下をもたらすとされている[135, 136]。グルタチオン(GSH)、L-システイン、N-アセチルシステイン(NAC)、タウリン、メラトニンなどの内因性チオールは、重要な抗酸化物質の一例である。これらの抗酸化物質は、金属の利用可能性を減らし、臓器細胞や生体高分子へのダメージを減少させ、解毒を促進することができます。抗酸化物質は、フリーラジカルの消去、ラジカル連鎖反応の中断、鉛を含む重金属との安定した複合体形成など、様々な作用機序で働く[121, 137]。したがって、ASD児の体内の抗酸化物質のレベルは低下しており、児の脳における重金属の隔離を促進し、その後、尿中の重金属の濃度が低くなると考えられる[121]。
鉛に対する必須微量元素の役割
尿中Pbのほか、ある種の必須微量元素の濃度がASD児ではTD児より有意に低かった。尿中Zn(ASD児39.81μg/dLに対してTD児88.88μg/dL)、尿中Fe(ASD児34.69μg/dLに対してTD児58.32μg/dL)であった。また、尿中Mg濃度はASD児の方がTD児より低値であったが、有意差はなかった。しかし、年齢と性別を調整すると、4歳以上の子ども(ASD児102.34μg/dL、TD児140.45μg/dL)、男性(ASD児106.00μg/dL、TD児139.96μg/dL)では尿中Mgの平均値の差は顕著に現れていることが確認された。一方、4歳以下のASD児では、TD児に比べ尿中Caが有意に高いことが示された(ASD児107.95μg/dL vs TD児34.18μg/dL)。
本研究における必須微量元素の一変量所見は、Mg、Zn、Feに関する先行研究と整合的である。例えば、Skalnyらは、ASD児の毛髪中Mg濃度(ASD児17.91μg/g対TD児18.84μg/g)および尿中Mg濃度(ASD児108.59μg/ml対TD児118.51μg/ml)が非対象TD対照より低いことを実証している。しかし,その結果は有意ではなかった[138]。Priyaらは、低機能自閉症(LFA)(平均174.02 ± 20.88 μg/g)、中機能自閉症(MFA)(平均202.21± 24.26 μg/g)、高機能自閉症(HFA)(平均236.31 ± 28.35 μg/g)の子供の毛髪中のMg濃度が対照群(平均454.36 ± 54.52 μg/g)より有意に低かったことを実証している。この知見は、毛髪中のMg濃度レベルの減少に伴ってASDの重症度が上昇することを示唆した[139]。Strambiらは,ASD児の血漿Mg濃度(平均2.27 ± 0.33 mg/100 mL)が,マッチしない健常児(平均2.51 ± 0.14 mg/100 mL)に比べ有意に低いことを示した[70]。システマティックレビューとメタアナリシス研究は、ASD児の毛髪(効果量-0.612、z値=2.68、p=0.007の異常値研究を除去後)と血清(効果量-0.105、z値=5.88、p < 0.001)中のMgレベルが健常対照に比べて著しく低いことを報告している[140]。
Znについては、PriyaらはLFA児の毛髪中のZn濃度(平均130.46±15.65μg/g)が対照群(平均171.68±20.60μg/g)より有意に低いことを示した[139]。Liらは,ASD児の血清中のZn濃度(平均78.70±7.00ng/mL)は,年齢と性別をマッチさせた健常対照群(平均87.70±8.70ng/mL)と比較して有意に低いと報告している[141]。Saghazadehらは、2つの外れ値の研究を除外した後、ASD患者(n = 513)が対照(n = 333)よりも血中Znレベルが低いことを示す-0.361(z値= 2.31, p = 0.021)の有意な効果量を報告した。さらに感度の高い毛髪サンプル分析では、外れ値の研究を除外した後、アジア人のASD患者(n = 236)は、アジア人の患者(n = 306)よりも毛髪中のZnレベルが低い(標準化平均差(SMD) = -1.493, p = 0.002)ことが示されました[140]。
Feについては、LubkowskaらがASD児の毛髪中のFe濃度(平均9.02±4.62μg/g)が年齢を合わせた健常対照者(平均10.05±2.92μg/g)より著しく低いことを実証しています[142]。さらに,Saghazadehらは,外れ値の研究を除外した上で,ASD児の毛髪中のFe濃度が健常児よりも低いことを示す-1.410(z値=2.38,p=0.017)の有意な効果量を報告している[140]。
Ca については、他の微量元素(Mg、Zn、Fe)と一変量解析が矛盾している。しかし、最近の研究では、年齢と性別をマッチさせた神経症児(中央値106.71、25-75パーセンタイル103.82-112.3)よりもASD児(中央値109.16、25-75パーセンタイル103.55-113.5)の血清中に高いCa濃度が見出され、同様の結果が報告された[143]。しかし、結果は非有意であった。
尿中微量元素の回帰分析から、尿中ZnはASDの保護因子であると思われた(OR = 0.95, 95% CI 0.91, 0.99, p = 0.008)。尿中Znによる保護効果は、さらに交互作用解析を行ったところ、有意に増加した(OR = 0.89, 95% CI 0.83, 0.95, p = 0.001)。尿中FeはASDに対して保護効果を発揮することがわかった(OR = 0.77, 95% CI 0.69, 0.87, p < 0.001)。しかし、尿中鉄分の保護効果は、さらなる交互作用解析の結果、減少し、有意ではなかった(OR = 0.95, 95% CI 0.73, 1.24, p = 0.698)。これらの知見は、体内の必須微量元素、特に Zn と Fe の存在が、鉛の神経毒性に対抗するために重要であることを意味する。
必須微量元素(Mg、Zn、Feなど)は抗酸化剤として重要な役割を果たし、それによって、これらの元素が体内に存在することで、組織における金属の再分配と蓄積を防ぎ、金属の利用率を下げ、毒性を減らし、細胞膜を安定させ、生体高分子へのダメージを減少させます[137]。これらの元素はまた、必須イオンの置換を減少させ、不溶性の金属-ミネラル複合体を形成し、金属結合タンパク質(MT)を生成することによって、催奇形性の毒性を減少させる[137]。必須微量元素はまた、重金属の消化管吸収を減少させ、競合的吸収メカニズムによってその分布を減少させる[137]。しかし、我々の知見はこの説を支持することができなかった。尿中 Pb と必須微量元素の相関は、尿中 Pb と Ca の相関が非有意に負の非常に弱い相関を示した以外は、有意に正の非常に弱いから中程度の相関係数 (r 値は 0.19 から 0.44) を示した (p > 0.05) 。
ASDのその他の関連因子の評価
ASDのいくつかの関連因子が同定された。これらの要因は、民族性、親の教育、子供の性別、親の喫煙状況であった。我々の発見は、第三次教育を受けた親は、中等教育を受けた親に比べ、ASD児を持つ確率が26倍であることを示した(OR = 26.15, 95% CI 7.10, 96.38, p < 0.001)。この知見は,Eowらによって支持され,第三次教育を受けた母親のASD児を持つオッズは,中等教育以下の母親と比較して3.5倍高かった(OR = 3.47,95% CI 1.00,5.94) [144] 。
民族別では、ASD児群(n=18/63(22.2%))とTD児群(n=4/70(5.4%))で非マレー人の割合が少なかった。しかし、民族性(非マレー人)はASDの有意な危険因子であった(OR =7.52, 95% CI 1.62, 34.85, p = 0.010)。マレー系以外の子どもは、マレー系の子どもと比較してASDを発症する確率が約4.5倍であると報告した研究がある(OR = 4.52, 95% CI 2.10, 6.94)[144] 。
性別については、ASD児の男女比は5:1であった。この比率は、これまでに報告されている4:1[145]や3:1[146,147]よりも高い。したがって、男性の性別はASDの有意な危険因子であった(OR = 8.52, 95% CI 2.76, 26.28, p < 0.001)。
最後に、元喫煙者である親(父親か母親)は、非喫煙者の親よりもASD児を持つ確率が高いという結果が出た(OR = 25.29, 95% CI 4.03, 158.68, p = 0.001) 。しかし、現役の喫煙者である親ではこの所見は有意ではなく、重金属(鉛を含む)に対する曝露は出生前および出生前の期間に起こる可能性があることを示している。親が禁煙を決意するのは、子どもがASDと診断されたことに影響されるかもしれない。妊娠中の母親がセカンドハンドスモーカー(主に喫煙している夫や配偶者に関係)であっても、ASD児のリスクは依然として高い(OR = 3.53, 95% CI 1.30, 9.56) [148].
推薦の言葉
本研究は、ASDの予防策、特に環境衛生と栄養の観点に焦点を当てた。安全な鉛の濃度は存在しないので、幼児は鉛に曝露されるべきではない。それでも曝露される場合は、曝露量を最小にする必要がある。トップ・ステークホルダー(=政府)は、関連する法律・法規の施行により予防策を開始し、改善すべき である。現在の規制では、鉛の基準値は頻繁に改訂され、必要に応じて修正されるべきとされている。鉛を含む製品製造(例:塗料、陶磁器、玩具、電気・電子機器)の管理・監視を強化する必要がある。
また、政府、特に保健省が新生児と就学前児童を対象とした初の全国的な鉛スクリーニング・プログラムを開始することを提言する。この方法は、数十年前にアメリカで行われた。このプログラムは、おそらく家族の社会・人口統計的背景をリスクに基づいて評価することにより、高リスクの乳幼児グループを特定することから始めることができるだろう。さらに、国レベルでの小児暴露の有病率や環境関連疾患の負担を特定し、分析することで、関係者がさらなる行動を起こすことができるだろう。MOHはまた、目的(短期または長期の暴露モニタリング)と実験室での分析コストに応じて、バイオモニタリングのためのさまざまな種類の試料を決定することができる。家族レベルでは、両親または養育者は、子供への鉛の曝露を最小限に抑えるために、有害な環境要素の健康への影響について十分な知識を持つべきである。鉛の曝露に関する保護者の知識は、マスメディア、電子社会メディア、ヘルスケアセンター(例:保健所や病院)のいずれかから、様々な健康教育を通じて向上させる必要がある。
栄養面では、保護者が必須微量元素を十分に摂取することをお勧めします。この記事で述べたように、必須微量元素は、十分に摂取することで子どもの体に多くの恩恵をもたらします。MOH, National Coordinating Committee on Food and NutritionによるRecommended Nutrient Intakes (RNI) for Malaysia 2017 [77]によると、1~3歳児の推奨Ca摂取量は1日700.0mg、4~6歳児は1日1000.0mgとされています。Mgについては、1~3歳および4~8歳の子どもの推奨摂取量は、それぞれ1日80.0mgおよび1日130.0mgである。一方、Znは1〜3歳が1日4.2mg、4〜6歳が1日5.2mgと推奨摂取量が定められています。最後に,1-6 歳児の推奨 Fe(生体内利用率 10.0%)摂取量は 1 日 6.0mg であるが,1-6 歳児の推奨 Fe(生体内利用率 15.0%)摂取量は 1 日 4.0mg である。
制限事項
本研究の結果は慎重に解釈されるべきものである。鉛および必須微量元素は尿検体でのみ調査され、これらの元素によって脳内で起こる複雑な病理学的メカニズムを十分に説明できない可能性がある。また、ASD児のPb濃度が比較的一定しないのは、ASDの異質性(スペクトラム)、被験者の多様な地理的位置、あるいは方法論の違いに起因している可能性がある。しかしながら、これらの結果は、ASDにおける鉛および他の重金属の役割の可能性を調査するために、さらなる研究が必要であることを示している。
結論
両グループの尿サンプル中のPb濃度レベルは、CDCの上昇レベル以下であった。また、ASD児のPb濃度レベルはTD児より有意に低いことがわかった。Pb濃度レベルが低いのは、解毒機構が悪く、Pbを体内に多く保持する一方で、尿中へのPbの排泄量が少ないためと考えられる。また、必須微量元素である尿中Mg、Zn、Feの濃度が有意に低いことが、ASD児におけるPbの神経毒性作用を増強している可能性がある。これらの知見は、ASD児の中枢神経系を保護するために必須微量元素が重要であることを示唆している。予防戦略は一貫したものであるべきで、利害関係者や両親の参加を得て、子供たちの鉛への暴露を最小限に抑えるようにすべきである。予防戦略は、就学前児童のASDの発生と進行を抑えるために、最適な栄養を提供することが重要である。
ASDの性差の神経トランスクリプトーム解析
自閉症スペクトラムの性差の神経トランスクリプトーム解析。現在の知見と今後の方向性
リー・T・キセルら、Biol Psychiatry.2022.
無料論文
詳細を表示
全文リンク
概要
自閉症スペクトラム障害(ASD)は、一貫して男性が女性の3~5倍の頻度で診断されており、この劇的な性差のある有病率は、リスクの調節に性差のある生物学的因子が関与していることを示唆している。ヒト脳組織のトランスクリプトーム解析は、性差とASDの影響を受けた神経生物学の交差点にある遺伝子と関連する機能的プロセスを同定するための偏りのないアプローチを提供することができる。近年、ASD脳における遺伝子発現の変化を特徴づけるいくつかの研究が、サンプルサイズと細胞解像度を上げて発表されている。これらの研究では、グリアや免疫機能に関連する遺伝子セットの発現上昇、ニューロンやシナプス機能に関連する遺伝子セットの発現低下など、ASD脳におけるデータセットや遺伝的に異質なサンプル間でいくつかの収束的パターンが報告されています。神経型大脳皮質組織の評価では、男性ではグリア・免疫関連遺伝子の発現が上昇し、女性ではニューロン関連遺伝子の発現が低下するという、性差による並行パターンが報告されており、性差によるASDリスク機構においてこれらの細胞タイプの役割が期待されます。しかし、ASD脳の既存研究では、ASD女性ドナーの数が限られており、顕著な性差の形態や機能を示すことが知られていない大脳皮質領域に主に焦点を当てているため、これらのメカニズムの検証やさらなる探求は、利用可能なデータからは困難である。本総説では、ASD脳のトランスクリプトームに関するいくつかの画期的な研究から得られた収束的な知見と、性差のある遺伝子発現との関係をまとめ、ASDにおける性差のトランスクリプトーム解析に関する限界と残された疑問について考察している。
キーワード自閉症スペクトラム、大脳皮質、遺伝子発現、性差、トランスクリプトミクス。
自閉症スペクトラム(ASD)は、広範な神経発達障害であり、現在、米国の小児の約54人に1人が罹患していると言われています(1)。ASDは、女性に比べて男性で3~5倍多く診断されており(1,2)、神経精神疾患の中で最も性差のある疾患の一つであると言われています。このような有病率の差にもかかわらず、ASDの臨床的表現型を男女で比較した大規模な研究では、女性では制限的行動や反復的行動が減少し(3、4、5、6)、社会的コミュニケーション特性に関する性差の影響が見られる(4、5)ものの、全体の重症度は男女間で同様である(3、4)ことが報告されている。ASDのリスクには、一般的な遺伝性変異(7,8)と稀なde novoの高悪性度変異(9,10)の両方が寄与していると言われています。FMR1(脆弱X症候群)(11)、MECP2(レット症候群)(12)、NLGN3、NLGN4X(13)など、いくつかのX染色体遺伝子座が関与しているが、既知のリスク変異の大部分は常染色体である(8, 9, 10)。CHD8、MBD5、SYNGAP1における稀なdeleterious variantsのASD症例における男性偏在など、いくつかの常染色体ASDリスク遺伝子は、ある性において優先的に発達障害と関連しているが(14)、そのメカニズムは十分に理解されていない。
組織や細胞における分子機能をゲノムスケールで近似的に読み取ることができるため、脳におけるトランスクリプトーム解析は、脳疾患の神経生物学的な探求に有用であり、遺伝子探索作業を補完する情報を提供することができる。適切な統計手法を適用すれば、ゲノムスケールでのトランスクリプトーム解析により、疾患に関与する生物学的プロセスを偏りなく発見でき、ゲノムスケールのデータセット間でバイオインフォマティクス的に比較し、収束点を特定することが容易になります。また、トランスクリプトーム解析は、特定の疾患や形質における性差の特徴づけにも応用でき、罹患した男性と女性の差や性差によるリスクメカニズムなどを明らかにすることができる。障害に対する性差のある病因や反応を示唆するような、障害状態の男女差を同定するには、十分な検出力を持ち、バランスのとれた患児男女のサンプルが必要です(図1A)。性差リスクの調査には、性差と障害生物学の両方に影響される遺伝子と関連する生物学的プロセスを特定するために、症例対照比較とベースラインの神経型性差の特徴を統合することが必要である(図1B)。

図1性差のトランスクリプトーム解析の研究デザインと成果。(A)障害状態における性差の特徴を明らかにするには、男性と女性の症例を比較する必要がある。(B)性差のあるリスクに関与する遺伝子やプロセスを同定するには、神経型の男性と女性の対照群、対照群と症例群の比較が必要である。(病態推定遺伝子は、障害状態や罹患頻度の高い性で発現が上昇することが予測される。(D)推定される保護遺伝子は、障害状態では発現が減少し、罹患頻度の低い性で発現が増加すると予測される。
このような遺伝子は、リスクに対する影響の方向性によってさらに分類することができる。障害のある状態、および障害の多い性(ASDでは男性)で高発現している遺伝子は、障害の病態の性差による脆弱性メカニズムに関与しているか、あるいはタグを付けている可能性が高い(図1C)。健康な状態およびASDに罹患している頻度が低い性(ASDでは女性)で高発現している遺伝子は、性差による保護機構に関与しているか、あるいはタグ付けされている可能性が高い(図1D)。ASDの性差リスクメカニズムを探るトランスクリプトーム研究の大きな目標は、男性の脆弱性の増幅や女性のリスクの低減に関与するこれらの遺伝子を見つけることである。
この目標を念頭に置き、本総説では、ASD脳組織のトランスクリプトームパターンに関する画期的な研究から得られた主要な結果を明らかにし、ASDに関連する変化が神経型の性差とどのように交差しているかを説明することを目的としている。また、これらのパターンが性差リスクメカニズムに与える影響、現在利用可能なデータセットの限界、そして今後の研究に残された疑問についても議論している。
ASD脳からのトランスクリプトームデータの利用可能性
これまでに、ASDと対照脳の組織や細胞におけるトランスクリプトームの違いを特徴づけるいくつかの画期的な研究が発表されている(15、16、17、18、19)。しかし、ASDドナーから入手できる脳組織はまばらであるため、これらの研究は限られたサンプルサイズに依存しており(表1)、初期の遺伝子発現研究(15)におけるわずか6人のASDドナーから、バルク脳組織トランスクリプトミクスに関する最新の報告(18)における48人のASDドナーの範囲にとどまっている。重要なことは、研究サンプルが完全に独立していないことである。これら5つの研究でアッセイされた組織は、合計で160人のユニークなドナーに由来するものであった。ASD69名、対照群91名である。これは、ASDの遺伝的・表現的不均質性に取り組むには比較的少ない数であり、CommonMind Consortiumが最近発表した353例を含む統合失調症など、他の精神神経疾患のトランスクリプトームデータ作成にも遅れをとっています(20)。組織の入手可能性から、両疾患の脳トランスクリプトーム研究は、最近のゲノムワイド関連研究では18,381例のASD(8)と36,989例の統合失調症(21)、希少変異解析では11,986例のASD(10)と3444例の統合失調症(22)の遺伝子解析と比較すると、制限されている。
表1ASD脳のトランスクリプトーム研究でアッセイされた組織ドナーと脳部位

各試験におけるドナー個体の総数およびアッセイされた脳部位を記載。
ACC、前帯状皮質;ASD、自閉症スペクトラム障害;BA、ブロドマン野;PFC、前頭前野;RNA-seq、RNAシークエンス;STG、上側頭回。
ASDの有病率が男性に偏っていることと同様に、すべてのデータセットが男性優位であり、ASDの全ドナー69名のうち、女性は14名のみである。適切に、すべての症例群と対照群は性別が一致しており、症例対照の状態と性別が交絡する可能性は低いが、解析に利用できる女性の脳トランスクリプトームの数は直接的に制限される。このように症例および対照となる女性からのデータが少ないことは、1)大うつ病性障害(23,24)や心的外傷後ストレス障害(25)で観察されているような男性と女性のASD症例間の発現パターンの差異、2)女性のASD脳が性特有の期待からいかに乖離しているかを明らかにするための女性の症例と対照間の差異、3)男女間でASDトランスクリプトームの変化が影響の大きさや方向性に違いがある、性-診断間効果について明らかにするための大きな課題となっています。
ASD脳におけるトランスクリプトーム変化
サンプル数は比較的少ないものの、バルク脳組織の研究により、ASD神経トランスクリプトームの変化を説明することに成功している。より一貫して観察されるパターンの一つは、アストロサイト、ミクログリア、免疫、および炎症機能に関連する遺伝子の発現の上昇であり、これはGarbettらによって初めて報告された(15)。Autism Tissue Program(現Autism BrainNet, www.autismbrainnet.org)のASD-対照群6組のマイクロアレイデータの差分発現解析により、ASD上側頭回では抗原特異的・細胞特異的免疫反応、炎症、自己免疫、免疫介在細胞死Gene Ontologyカテゴリーに富む遺伝子が発現上昇していることが明らかにされた。その後、マイクロアレイ(16)やRNAシークエンシング(17,18)を用いたバルク組織の大規模な研究により、遺伝子共発現ネットワーク(モジュール)の発見と機能アノテーションにより、このパターンが再現されている。特に、Voineaguら(16)は、アストロサイトとミクログリアの機能に関連する遺伝子に富み、ASD脳で対照群と比較して発現が増加している、M16とラベルされたモジュールを同定した。2014年のGuptaらの研究(17)では、より大きなサンプルと符号付きの共発現ネットワークを用いて、M16をアストロサイト関連(Mod7)と活性化ミクログリア関連(Mod5)の別々のモジュールに分解したが、ASD-発現上昇したMod5のみが多重検定補正後に有意であった。Parikshakらによる最新かつ最大の研究(18)では、ASDで有意に発現が上昇する3つのモジュールを特定し、そのうちの1つはアストロサイトマーカーに富み(CTX.M9)、もう1つはミクログリアマーカーに富む(CTX.M19)ことが明らかになり、このシグナルの分解能がさらに拡大された。
これらのグリア関与の推定される変化が、上流リスク曝露の二次的結果であるか、アストロサイトおよびミクログリアがASDの一次的な症状関連病理に関与しているかは不明である。ここで紹介したどの研究でも、ASDで上昇したグリア/免疫関連モジュールのいずれにおいても、希少または一般的な変異体を含むASD遺伝的リスク因子の濃縮は観察されず、これらの上昇した発現パターンを駆動する機能変化は、遺伝的リスク変異の直接的影響から下流にある可能性が高いことが示唆された。これらの変化が原因因子の下流か上流かにかかわらず、ASD症状の上流にある(そしてASD症状に寄与している)可能性は残っており、それは治療標的としてのグリア/免疫経路の有用性に影響を及ぼすと思われる。この可能性については、今後の実験的研究が必要である。
一括組織トランスクリプトーム解析では、ASD大脳皮質で一般的に発現が低下している神経細胞やシナプス機能に関連するモジュールも同定されている。Voineaguら(16)は、シナプス機能、小胞輸送、神経細胞投射に関連するASD制御の神経細胞モジュール(M12)を報告し、Guptaら(17)は、M12を、シナプス伝達機能に富む3つの符号付きモジュールに分解している。この3つのうち、Mod6はASDで有意に発現が上昇し、シナプス伝達と関連する抑制性イオンチャネル活性に関連することが判明したMod1遺伝子は有意に発現が低下していた。Parikshakら(18)はその後、M12モジュールとも重複し、神経細胞マーカーやシナプス遺伝子に富む3つのASD-downregulatedモジュール(CTX.M4, CTX.M10, CTX.M16)を特定し、これらの著者もCTX.M10とCTX.M16モジュールの主要機能として神経細胞の発射速度に関係していると述べている。
アップレギュレートされたグリア/免疫遺伝子とは対照的に、ダウンレギュレートされた神経/シナプス遺伝子はASD遺伝的リスクと重なる証拠を示し、これらの遺伝子の発現の変化がASDの原因ルーツに近い可能性を示唆する可能性がある。初期のASDゲノムワイド関連研究(26)から得られた共通バリアント関連シグナルの遺伝子セットの濃縮度を評価するために並べ替え検定を用い、Voineaguら(16)はM12遺伝子がASD共通バリアントリスクに有意な濃縮度を示すことを観察した。しかし、Guptaら(17)やParikshakら(18)の知見は、その初期の遺伝的リスクの濃縮を支持せず、代わりにASDで有意な発現変化を示さなかったモジュールでのみASDの希少バリアントリスク遺伝子の濃縮を見出し、ASDアップレギュレーションCTX.M20モジュールではASDゲノム全体関連研究シグナルの一般バリアント濃縮は弱いと判断した。これらの対照的な知見は、神経細胞に影響を与える上流の遺伝的リスクと下流の転写変化が、分離可能な遺伝子セットと機能に関与している可能性を示唆するものである。
ASD脳のバルク組織解析で報告されたその他の発現変化には、脳領域間の差異、異なる遺伝的病因の症例間の類似性、個人ドナー間の差異などがある。大脳皮質と小脳組織の両方を評価した研究(16,18)では、大脳皮質でより大きな発現変化が観察され、小脳に対して大脳皮質で有意なASD差発現遺伝子数(444対2遺伝子(16)、1142対0遺伝子(18))がかなり多く、ASDの転写変化に対する生後大脳の感受性がはるかに高いことを示している。前頭葉と側頭葉の組織を比較した発現差解析では、ASDでは領域ごとに異なる発現を示す遺伝子の数が減少しており[対照試料では510(16)遺伝子と551(18)遺伝子、ASD試料では8(16)遺伝子と51(18)遺伝子]、ASDでは皮質のパターンが明確ではなく、破綻している可能性があることが示唆された。15q11.2-13.1重複症候群(dup15q)患者9名のデータを特発性ASD症例からのサンプルと一緒に解析したところ、これら2つの症例グループのトランスクリプトーム変化には著しい類似性があり(18)、異種遺伝リスク暴露の下流で神経生物学的変化が収束することが示唆されました。しかし、個々のサンプルにおける発現変化は、グループ平均が示唆するよりも多様である。ASDドナーの組織は対照サンプルに比べ、神経細胞/シナプス系遺伝子の発現が相対的に低下し、グリア/免疫系遺伝子の発現が上昇する傾向があるが、これはすべてのASDサンプルに共通するものではない(図2)。また、女性サンプルも男性サンプルと同様のパターンを示すことから、これらの方向性のある発現変化は男性特異的なものではないようである。

図2側頭葉におけるASD関連遺伝子の共発現モジュール。側頭葉のサンプル(x軸)間のモジュール固有遺伝子値(y軸)の視覚化。各性別診断群内では、サンプルは年齢の昇順に表示されている。ASDで発現が増加したモジュール(CTX.M9、CTX.M19、CTX.M20)は左に、ASDで発現が減少したモジュール(CTX.M4、CTX.M10、CTX.M16)は右に示している(18)。ASD、自閉症スペクトラム障害、CTL、コントロール。
バルク組織解析で得られた発現量の異なる遺伝子は、特定の細胞型の機能に注釈を付けることができますが、バルク組織解析では、これらの発現変化の細胞由来を決定的に分離することはできませんし、細胞数の影響と細胞型固有の発現変化を決定的に区別することもできません。シングルセルのRNA配列解析は、これらの不明な点を解決するために始められる。Velmeshevら(19)は、ASD症例と4~22歳の対照被験者の前頭前野と前帯状皮質から単一核RNAシーケンスデータを作成し、ASDに関する最初のデータセットを発表した。同定された17の細胞型クラスターのうち、原形質性アストロサイトのみが対照被験者よりもASDに比較的多く存在することが判明し、細胞型構成の変化がASD脳組織に見られるグリア/免疫遺伝子発現上昇に寄与している可能性が示唆されました。さらに、各クラスター内で実行された細胞型特異的な発現差解析により、ASDで最も有意に上昇した遺伝子は原形質アストロサイトまたはミクログリアで主に観察され、ASDで最も有意に低下した遺伝子は皮質層2/3興奮性ニューロンおよび血管作動性腸ポリペプチド陽性介在ニューロンで主に観察されることが示された。また、本研究では、層4と層2/3の興奮性ニューロン、血管作動性腸ポリペプチドとソマトスタチン陽性の介在ニューロンにおいて、差次発現遺伝子のうち希少なバリアント関連ASDリスク遺伝子が予想以上に濃縮されていることが報告された。同様に、扁桃体における独立した解析(27)では、扁桃体介在ニューロンにおけるASDリスク遺伝子のダウンレギュレーションが報告されたが、扁桃体のミクログリアやアストロサイトにおけるASD関連遺伝子のアップレギュレーションは観察されず、このパターンは領域特異的である可能性が示唆された。これらの初期の知見は有望であり、今後、より多くの個人ドナーや幅広い脳領域からのデータ作成により、細胞レベルでASDを特徴づける分子の変化や、それらが遺伝的感受性や全体のASD病態とどのように関連しているのかについて、貴重な知見が得られると思われる。
神経型性差発現がASDと対照の差に関係すること
対照サンプルと比較したASD脳組織のトランスクリプトーム変化は、障害状態に関連した変化を定義し、ASDの性差リスクメカニズムを解明するためには、これらの障害関連パターンが神経型性差とどのように交差し、または相互作用するかを理解する必要がある(図1B)。2016年の研究(28)では、神経型大脳皮質組織からの一連の性差発現解析の結果を、ASDに関連する遺伝子発現変化やリスク遺伝子と比較することで、この疑問に直接対処している。具体的には、Werlingらは線形混合効果モデルを適用して、3つのデータセットにおける性差発現の特徴を明らかにした:BrainSpanからの13-40歳の男性5人と女性5人のドナーの58個の皮質サンプルからなる成人の発見データセット、妊娠後16-22週の男性4人と女性4人のドナーの86個の皮質サンプルによる出生前データセット、16-56歳の男性と女性の5人のドナーの13個の皮質サンプルによる成人再現データセットである。
当時定義されたASD上昇型グリア・免疫モジュール(M16とMod5)(16,17)のいずれかに属する遺伝子は、成人の発見データと出生前データセットの両方で、女性偏重よりも男性偏重の発現を示す傾向が著しく、M16遺伝子は成人の複製データでも著しく男性偏重であった。成体および出生前の大脳皮質における男性に偏った遺伝子は、複数のソースで定義されたアストロサイトおよびミクログリアマーカー遺伝子にも有意な濃縮を示した(29,30)。逆に、ASDで制御される神経/シナプスモジュール(M12、Mod1)に属する遺伝子は、成体発見データでは女性に偏った発現が有意に多かったが、このパターンは出生前や成体の複製セットでは観察されなかった。ASDリスク遺伝子は、SFARI (Simons Foundation Autism Research Initiative) Gene database (https://gene.sfari.org/) (31) からの候補遺伝子や、ASD症例において稀にde novo protein-truncating or missense variants (32) を持つ遺伝子を含むが、どのデータセットにおいても性差発現が強調されず、ASDの性差的有病率の駆動メカニズムは遺伝リスク変異から大きく下流で作動するというワーキングモデルとも一致している (28)(Philippine 2004)。
その後、BrainSpanデータセットの時空間的範囲における神経型性差発現の解析では、受胎後8週から40歳までの40人のドナー(男性23人、女性17人)から得た594個のサンプルを取り込んだ(33)。Parikshakら(18)が報告した6つのASD調節モジュールの大脳皮質組織における性差のある発現パターンを発達時間にわたって評価したところ、事前の観察を裏付ける結果となった。すべてのニューロン関連モジュールは発達にわたってほぼ性差のない発現を示し、アストロサイトおよびミクログリア関連モジュールでは胎児発達中期から後期に男性偏向発現、CTX.M9ではさらに成人期に男性偏向の発現を示している(図3)。CTX.M9で男性に偏る顕著なアストロサイト関連遺伝子には、APOE、ホルモンに対する神経反応に関連するRERGやSLCO1C1などの遺伝子が含まれている。CTX.M19はミクログリア機能に富んでおり、CTX.M19の男性に偏った遺伝子には、LYN、B2M、RHBDF2があり、これらは免疫細胞のシグナルとプロセスの制御と反応に関与している。出生前の性差についてさらに言及すると、120人の第2期のヒトドナーからの全脳におけるトランスクリプトームパターンを特徴付ける研究でも、性差のある発現を持つ2756個の遺伝子が発見された(34)。上記のBrainSpanの知見とは対照的に、これらの発現差遺伝子は、高信頼度のASDリスク遺伝子に有意な濃縮を示したが、性影響の方向は男性バイアス7、女性バイアス5のリスク遺伝子と分かれた。

図3ASDで制御されるモジュール遺伝子の発育時間による性差発現。Parikshakら(18)が同定した6つのASD-dysregulatedモジュール(上)またはupregulatedモジュール(下)に属するタンパク質コード遺伝子について、BrainSpanリソース(33)の前頭および側頭新皮質サンプルで観測された平均log2倍差(黒実線)が、8つの発達ウィンドウごとに表示されている(グレー破線垂直線)。赤青網掛けは、各遺伝子セットの平均log2 fold differenceの99%信頼区間を表示する。また、各モジュールの性差発現の後ろに、前頭葉および側頭葉皮質サンプルで発現した全17,222個のタンパク質コード遺伝子のlog2 fold differenceの中央値および四分位範囲を灰色で表示している。ASD、自閉症スペクトラム障害、FD、フォールドディファレンス、Fem、女性。
大脳皮質組織で見られるこれらのASDと性差のある発現パターンは、神経型男性(女性との比較)とASD(対照との比較)における神経生物学的特徴の並行シフトの存在を示唆している。アストロサイト/ミクログリア/免疫系遺伝子の男性偏重発現は、ASDで上昇した発現とは別であり、ASDで低下した神経/シナプス系遺伝子はデータセット間で様々に女性に偏っていることが一貫して観察された。いずれの機能カテゴリーにおいても、より頻繁に発症する性(男性)の神経型組織は、女性よりもASDに転写的に近く、グリア/免疫および/またはニューロンの生物学が性差リスクメカニズムに関与している可能性が示唆された。ASD対コントロールの効果の方向性から、グリア機能および/または細胞数の増加はASD病態に関連し、ニューロン機能または細胞数の維持または相対的な上昇は保護的であると仮定する(図1C、D)。細胞タイプの構成や分子機能がバルク組織に見られる性差にどのように寄与しているかを明らかにするには、より広範なシングルセル・トランスクリプトミクスを含むさらなる研究が必要であり、これらの細胞タイプが関わる推定上の病態生理および保護機構を調べるには神経生物学的実験が必要であろう。重要なことは、ASDの遺伝的リスクに関連する遺伝子が大脳皮質組織で性差なく発現していることから、少なくとも大脳皮質では、性差のあるリスク調節機構がリスク遺伝子発現の上流調節因子としてではなく、遺伝的リスク因子の下流に作用していることが示唆されたことである(28)。ASDのような遺伝的に異質な疾患では、下流の病態を標的とした介入により、多様な遺伝的病因の患者の症状を調節できる可能性が示唆され、希望が持てる観察結果である。
結論、限界、今後の方向性
ここでレビューした研究は、ASDの神経生物学と性差リスクメカニズムに関する洞察を提供するが、これらの知見は、性、年齢、脳領域、細胞タイプなど多次元にわたるサンプル入手可能性によって制限される。現在、主要なトランスクリプトーム研究において14人の女性ASDドナーのデータしか得られていないため、発症した男性と女性の性差を特徴付けること、性別をマッチさせた標準からの女性特有のシフトをアッセイすること、性別とASDの相互作用を特定することが著しく妨げられている。
また、このような特徴づけの努力は、年齢によってさらに複雑になる。ASDは神経発達障害でありながら生涯続く疾患であるため、ASD脳における遺伝子発現の変化は、発達の過程で静的なものではありません。性差生物学も同様にダイナミックで、初期の性分化、思春期、更年期を含む定義された段階を経て展開し、変化していく。ASDの性差リスクと神経病理を徹底的に理解するためには、これら2つの発達的に動くターゲットの相互作用を理解することが必要である。発達初期に関しては、神経型と思われるヒト組織からのトランスクリプトームデータは、ASDリスク遺伝子も強く発現・共発現する時期である胎児期が比較的多く利用できる(35,36)。しかし、胎児後期や幼児期のヒト組織サンプルは少なく、出生前の推定ASD組織へのアクセスには、すでに稀な疾患に対する胎児遺伝子診断が必要となる。ここで紹介したASD研究サンプル(表1)やBrainSpan(33)やBrainVar(37)のような発達に焦点を当てたデータセットには思春期にわたるサンプルが含まれているが、いずれもドナーの思春期に関する表現型情報がなく、この段階で十分に検出力のある比較をするには男女の数が不足している。成人期はGenotype-Tissue Expression(GTEx)プロジェクト(38)などの大規模データセットで十分カバーされているが、後者は高齢者に偏っており、含まれる女性の大半は閉経前後であると思われる。神経系組織では、男女比はGTExで約2.5:1、BrainSpanで1.3:1、BrainVarで1.4:1、出生後サンプルで2.4:1である。
ASD脳の既存のトランスクリプトームデータも地域的に限られており、主に大脳皮質と小脳に焦点が当てられています。ASDリスク遺伝子は大脳皮質組織(35,36)や皮質ニューロン(10)で強く発現しており、ASD(15, 16, 17, 18, 19)や神経型男性(28)の皮質ではトランスクリプトーム変化が明らかだが、多くの皮質下脳領域ではASD関連変化がまだ特徴づけられていない。したがって、ASDの病因と性差生物学が大脳皮質で直接相互作用するのか、あるいは他の脳領域が性差リスク機構においてより大きな役割を担っているのかは不明である。神経内分泌学や神経行動学の豊富な研究により、視床下部や線条体終末核などの皮質下の脳領域における細胞的・形態的性差が詳細に報告されている(39)。これらの皮質下領域もASD関連病理に直接かつ強固に関与している可能性があり、あるいは性差領域とASD罹患領域を物理的につなぐ神経回路を介してASDリスクを調節している可能性もある。しかし、これらの領域のバルク組織トランスクリプトームは、その解剖学的複雑さ(例えば、複数の小さく機能的に異なる視床下部核)のために、これまでほとんど優先されてきませんでした。現在では、単一細胞および空間トランスクリプトーム技術により、これらの困難な領域の特性解析が容易になりつつあり(40)、ASDの性差リスクへの関与を明らかにする、あるいは排除するために応用することが可能である。皮質下領域であれ皮質であれ、シングルセル解析は、ASD病理学や性差生物学に直接関与する細胞タイプおよび/または細胞状態、そしてこれらの細胞タイプが表現型に寄与する可能性の高いメカニズムをより明確にするために不可欠であろう。すでに、大脳皮質の単一細胞トランスクリプトームデータから、ASD関連遺伝子発現パターンにおいて、細胞型構成と細胞型特異的変化の両方が関与する可能性が示唆されているが(19)、これらの知見を検証し改良するには、さらなるデータ生成が必要である。
今後、in vivoおよびin vitroのモデルシステムは、ASDに関連する遺伝的変異のトランスクリプトーム、機能、行動への影響を、男女ともに、正確に選択された発生段階において、また複数の脳領域で探索するための重要なツールとなるであろう。ヒトの大脳皮質と同様に、Chd8、Arid1b、Shank3b、16p11.2欠損などのASDリスク遺伝子座のいくつかのマウスモデルにおいて、軸索誘導やグルタミン酸神経伝達の神経機能に関連する遺伝子モジュールの転写産物が減少していることが判明した(41, 42, 43)。また、ASDリスク遺伝子の筆頭であるChd8のヘテロ接合型変異体では、他の既知のASDリスク遺伝子の発現が一貫して低下しており(43、44、45)、ある研究ではChd8+/-変異体で発現が上昇した遺伝子に免疫反応関連、ASD上昇遺伝子が濃縮されており(44)、また別の研究ではChd8+/-制御低下遺伝子にASD制御下、ニューロン関連遺伝子が濃縮されていた(45)。これらのパターンは、ヒトの脳で報告された変化を部分的に検証するものであり、特定の遺伝的リスク変異をより広範な下流のトランスクリプトーム結果と関連付けるための非ヒトモデルの可能性を示すものである。しかし、これらの研究は、これまでのところ、性差とは無関係の障害に関連した変化に焦点を当てており、今後の解析で直接取り上げられる必要がある。また、動物実験では、グリア遺伝子の発現上昇がASD病理の原因であるのか結果であるのか、まだ明らかにされていない。共発現ネットワークの変化の中心となる「ハブ遺伝子」を破壊する実験や、これらのモジュールに関連する特定の細胞タイプの機能を標的とする実験がさらに進めば、グリア機能の増加(あるいはニューロン機能の低下)が、脳機能や行動における表現型の変化に寄与しているか、あるいは単に相関しているかを明らかにするのに役立つだろう。
ASD患者サンプル由来のヒト人工多能性幹細胞(hiPSC)は、ヒト細胞であること、脳組織よりも入手しやすいこと、ごく初期の発生段階をモデル化できることなど、明確な利点があり、有用なモデルの一つである。興奮性・抑制性ニューロンに分化したhiPSCのトランスクリプトーム解析から得られた知見は、死後の脳組織と同様、ニューロン分化、ニューロン突起の発達とパターン形成、シナプスシグナルに関わる遺伝子ネットワークの調節障害などである(46,47)。しかし、現在のところ、hiPSCから誘導できる神経細胞の種類は限られており、性ステロイドホルモンを適用した場合としない場合のいずれにおいても、細胞培養系で性差生物学のどの次元を再現できるかはまだわかっていない。アストロサイトやミクログリア・ニューロンの共培養に必要な実験条件や、性差を適切にモデル化するための条件を探ることで、この分野の実験研究におけるhiPSCの有用性を前進させることができると考えています。
ヒトの研究からモデルシステムまで、ASDの女性サンプルは限られており、生物学的変数としての性への注目も限られているため、ASDの病態やリスクにおける性差を記述し理解することが妨げられてきた。ASDの障害状態や一般集団における性差をさらに明らかにすることは、ASDや性差のある有病率や症状を示す他の精神・神経疾患にとって重要であり、メカニズムを明らかにする実験的研究の舞台をより良く整えることになる。この目標に向けて、我々は個々の研究室、研究助成機関、ジャーナルが、すべてのヒトおよびモデル研究で女性のサンプルを含めることを促進または強制し、性差のある疾患であっても、可能な限り性差のないサンプルセットの分析を推し進めることを推奨している。障害の状態やリスクにおける性差を理解することは、障害の病理学の基本的側面を明らかにし、男女両方の患者に利益をもたらす治療法を設計する上で大きな可能性を持っているからである。
References
Maenner M.J.
Shaw K.A.
Baio J.
Washington A.
Patrick M.
DiRienzo M.
et al.
Prevalence of autism spectrum disorder among children aged 8 years–Autism and Developmental Disabilities Monitoring Network, 11 sites, United States, 2016.
MMWR Surveill Summ. 2020; 69: 1-12View in Article PubMed
Crossref
Google Scholar
Loomes R.
Hull L.
Mandy W.P.L.
What is the male-to-female ratio in autism spectrum Disorder? A systematic review and meta-analysis.
J Am Acad Child Adolesc Psychiatry. 2017; 56: 466-474View in Article Scopus (681)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Van Wijngaarden-Cremers P.J.M.
van Eeten E.
Groen W.B.
van Deurzen P.A.
Oosterling I.J.
van der Gaag R.J.
Gender and age differences in the core triad of impairments in autism spectrum disorders: A systematic review and meta-analysis.
J Autism Dev Disord. 2014; 44: 627-635View in Article Scopus (261)
PubMed
Crossref
Google Scholar
Kaat A.J.
Shui A.M.
Ghods S.S.
Farmer C.A.
Esler A.N.
Thurm A.
et al.
Sex differences in scores on standardized measures of autism symptoms: A multisite integrative data analysis.
J Child Psychol Psychiatry. 2021; 62: 97-106View in Article Scopus (15)
Crossref
Google Scholar
Frazier T.W.
Georgiades S.
Bishop S.L.
Hardan A.Y.
Behavioral and cognitive characteristics of females and males with autism in the Simons Simplex Collection.
J Am Acad Child Adolesc Psychiatry. 2014; 53: 323-329View in Article Scopus (199)
Abstract
Full Text
Full Text PDF
Google Scholar
Charman T.
Loth E.
Tillmann J.
Crawley D.
Wooldridge C.
Goyard D.
et al.
The EU-AIMS Longitudinal European Autism Project (LEAP): Clinical characterisation.
Mol Autism. 2017; 8: 27View in Article Scopus (57)
PubMed
Crossref
Google Scholar
Gaugler T.
Klei L.
Sanders S.J.
Bodea C.A.
Goldberg A.P.
Lee A.B.
et al.
Most genetic risk for autism resides with common variation.
Nat Genet. 2014; 46: 881-885View in Article Scopus (601)
PubMed
Crossref
Google Scholar
Grove J.
Ripke S.
Als T.D.
Mattheisen M.
Walters R.K.
Won H.
et al.
Identification of common genetic risk variants for autism spectrum disorder.
Nat Genet. 2019; 51: 431-444View in Article Scopus (507)
PubMed
Crossref
Google Scholar
Sanders S.J.
He X.
Willsey A.J.
Ercan-Sencicek A.G.
Samocha K.E.
Cicek A.E.
et al.
Insights into autism spectrum disorder genomic architecture and biology from 71 risk loci.
Neuron. 2015; 87: 1215-1233View in Article Scopus (651)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Satterstrom F.K.
Kosmicki J.A.
Wang J.
Breen M.S.
De Rubeis S.
An J.Y.
et al.
Large-scale exome sequencing study implicates both developmental and functional changes in the neurobiology of autism.
Cell. 2020; 180: 1-17View in Article Scopus (403)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Bassell G.J.
Warren S.T.
Fragile X syndrome: Loss of local mRNA regulation alters synaptic development and function.
Neuron. 2008; 60: 201-214View in Article Scopus (753)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Amir R.E.
van den Veyver I.B.
Wan M.
Tran C.Q.
Francke U.
Zoghbi H.Y.
Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2.
Nat Genet. 1999; 23: 185-188View in Article Scopus (3564)
PubMed
Crossref
Google Scholar
Jamain S.
Quach H.
Betancur C.
Rastam M.
Colineaux C.
Gillberg I.C.
et al.
Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism.
Nat Genet. 2003; 34: 27-29View in Article Scopus (1304)
PubMed
Crossref
Google Scholar
Turner T.N.
Wilfert A.B.
Bakken T.E.
Bernier R.A.
Pepper M.R.
Zhang Z.
et al.
Sex-based analysis of de novo variants in neurodevelopmental disorders.
Am J Hum Genet. 2019; 105: 1274-1285View in Article Scopus (18)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Garbett K.
Ebert P.J.
Mitchell A.
Lintas C.
Manzi B.
Mirnics K.
Persico A.M.
Immune transcriptome alterations in the temporal cortex of subjects with autism.
Neurobiol Dis. 2008; 30: 303-311View in Article Scopus (271)
PubMed
Crossref
Google Scholar
Voineagu I.
Wang X.
Johnston P.
Lowe J.K.
Tian Y.
Horvath S.
et al.
Transcriptomic analysis of autistic brain reveals convergent molecular pathology.
Nature. 2011; 474: 380-384View in Article Scopus (1141)
PubMed
Crossref
Google Scholar
Gupta S.
Ellis S.E.
Ashar F.N.
Moes A.
Bader J.S.
Zhan J.
et al.
Transcriptome analysis reveals dysregulation of innate immune response genes and neuronal activity-dependent genes in autism.
Nat Commun. 2014; 5: 5748View in Article Scopus (269)
PubMed
Crossref
Google Scholar
Parikshak N.N.
Swarup V.
Belgard T.G.
Irimia M.
Ramaswami G.
Gandal M.J.
et al.
Genome-wide changes in lncRNA, splicing, and regional gene expression patterns in autism.
Nature. 2016; 540: 423-427View in Article Scopus (290)
PubMed
Crossref
Google Scholar
Velmeshev D.
Schirmer L.
Jung D.
Haeussler M.
Perez Y.
Mayer S.
et al.
Single-cell genomics identifies cell type–specific molecular changes in autism.
Science. 2019; 364: 685-689View in Article Scopus (165)
PubMed
Crossref
Google Scholar
Hoffman G.E.
Bendl J.
Voloudakis G.
Montgomery K.S.
Sloofman L.
Wang Y.C.
et al.
CommonMind Consortium provides transcriptomic and epigenomic data for schizophrenia and bipolar disorder.
Sci Data. 2019; 6: 180View in Article Scopus (36)
PubMed
Crossref
Google Scholar
Schizophrenia Working Group of the Psychiatric Genomics Consortium
Biological insights from 108 schizophrenia-associated genetic loci.
Nature. 2014; 511: 421-427View in Article Scopus (4413)
PubMed
Crossref
Google Scholar
Rees E.
Han J.
Morgan J.
Carrera N.
Escott-Price V.
Pocklington A.J.
et al.
De novo mutations identified by exome sequencing implicate rare missense variants in SLC6A1 in schizophrenia.
Nat Neurosci. 2020; 23: 179-184View in Article Scopus (32)
PubMed
Crossref
Google Scholar
Seney M.L.
Huo Z.
Cahill K.
French L.
Puralewski R.
Zhang J.
et al.
Opposite Molecular Signatures of Depression in Men and Women.
Biol Psychiatry. 2018; 84: 18-27View in Article Scopus (99)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Labonté B.
Engmann O.
Purushothaman I.
Menard C.
Wang J.
Tan C.
et al.
Sex-specific transcriptional signatures in human depression.
Nat Med. 2017; 23: 1102-1111View in Article Scopus (270)
PubMed
Crossref
Google Scholar
Girgenti M.J.
Wang J.
Ji D.
Cruz D.A.
Traumatic Stress Brain Research Group
Stein M.
et al.
Transcriptomic organization of the human brain in posttraumatic stress disorder.
Nat Neurosci. 2021; 24: 24-33View in Article Scopus (17)
PubMed
Crossref
Google Scholar
Wang K.
Zhang H.
Ma D.
Bucan M.
Glessner J.T.
Abrahams B.S.
et al.
Common genetic variants on 5p14.1 associate with autism spectrum disorders.
Nature. 2009; 459: 528-533View in Article Scopus (743)
PubMed
Crossref
Google Scholar
Herrero M.J.
Velmeshev D.
Hernandez-Pineda D.
Sethi S.
Sorrells S.
Banerjee P.
et al.
Identification of amygdala-expressed genes associated with autism spectrum disorder.
Mol Autism. 2020; 11: 1-14View in Article Scopus (8)
PubMed
Crossref
Google Scholar
Werling D.M.
Parikshak N.N.
Geschwind D.H.
Gene expression in human brain implicates sexually dimorphic pathways in autism spectrum disorders.
Nat Commun. 2016; 7: 10717View in Article Scopus (118)
PubMed
Crossref
Google Scholar
Cahoy J.D.
Emery B.
Kaushal A.
Foo L.C.
Zamanian J.L.
Christopherson K.S.
et al.
A transcriptome database for astrocytes, neurons, and oligodendrocytes: A new resource for understanding brain development and function.
J Neurosci. 2008; 28: 264-278View in Article Scopus (2063)
PubMed
Crossref
Google Scholar
Zeisel A.
Munoz-Manchado A.B.
Codeluppi S.
Lonnerberg P.
la Manno G.
Jureus A.
et al.
Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq.
Science. 2015; 347: 1138-1142View in Article Scopus (1454)
PubMed
Crossref
Google Scholar
Basu S.N.
Kollu R.
Banerjee-Basu S.
AutDB: A gene reference resource for autism research.
Nucleic Acids Res. 2009; 37: D832-D836View in Article Scopus (246)
PubMed
Crossref
Google Scholar
Iossifov I.
O’Roak B.J.
Sanders S.J.
Ronemus M.
Krumm N.
Levy D.
et al.
The contribution of de novo coding mutations to autism spectrum disorder.
Nature. 2014; 515: 216-221View in Article Scopus (1252)
PubMed
Crossref
Google Scholar
Li M.
Santpere G.
Kawasawa Y.I.
Evgrafov O.V.
Gulden F.O.
Pochareddy S.
et al.
Integrative functional genomic analysis of human brain development and neuropsychiatric risks.
Science. 2018; 362: 1264View in Article Scopus (199)
Crossref
Google Scholar
O’Brien H.E.
Hannon E.
Jeffries A.R.
Davies W.
Hill M.J.
Anney R.J.
et al.
Sex differences in gene expression in the human fetal brain.
bioRxiv. 2018; https://doi.org/10.1101/483636View in Article Scopus (0)
Crossref
Google Scholar
Willsey A.J.
Sanders S.J.
Li M.
Dong S.
Tebbenkamp A.T.
Muhle R.A.
et al.
Coexpression networks implicate human midfetal deep cortical projection neurons in the pathogenesis of autism.
Cell. 2013; 155: 997-1007View in Article Scopus (512)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Parikshak N.N.
Luo R.
Zhang A.
Won H.
Lowe J.K.
Chandran V.
et al.
Integrative functional genomic analyses implicate specific molecular pathways and circuits in autism.
Cell. 2013; 155: 1008-1021View in Article Scopus (582)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Werling D.
Pochareddy S.
Choi J.
An J.-Y.
Sheppard B.
Peng M.
et al.
Whole-genome and RNA sequencing reveal variation and transcriptomic coordination in the developing human prefrontal cortex.
Cell Rep. 2020; 31: 1-17View in Article Scopus (25)
Abstract
Full Text
Full Text PDF
Google Scholar
GTEx Consortium
The GTEx Consortium atlas of genetic regulatory effects across human tissues.
Science. 2020; 369: 1318-1330View in Article PubMed
Crossref
Google Scholar
Gegenhuber B.
Tollkuhn J.
Signatures of sex: Sex differences in gene expression in the vertebrate brain.
WIREs Dev Biol. 2020; 9: e348View in Article Scopus (19)
Crossref
Google Scholar
Kim D.W.
Yao Z.
Graybuck L.T.
Kim T.K.
Nguyen T.N.
Smith K.A.
et al.
Multimodal analysis of cell types in a hypothalamic node controlling social behavior.
Cell. 2019; 179: 713-728View in Article Scopus (55)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Oron O.
Getselter D.
Shohat S.
Reuveni E.
Lukic I.
Shifman S.
Elliott E.
Gene network analysis reveals a role for striatal glutamatergic receptors in dysregulated risk-assessment behavior of autism mouse models.
Transl Psychiatry. 2019; 9: 257View in Article Scopus (5)
PubMed
Crossref
Google Scholar
Celen C.
Chuang J.C.
Luo X.
Nijem N.
Walker A.K.
Chen F.
et al.
Arid1b haploinsufficient mice reveal neuropsychiatric phenotypes and reversible causes of growth impairment.
Elife. 2017; 6e25730View in Article Scopus (47)
PubMed
Crossref
Google Scholar
Platt R.J.
Zhou Y.
Slaymaker I.M.
Shetty A.S.
Weisbach N.R.
Kim J.A.
et al.
Chd8 mutation leads to autistic-like behaviors and impaired striatal circuits.
Cell Rep. 2017; 19: 335-350View in Article Scopus (92)
PubMed
Abstract
Full Text
Full Text PDF
Google Scholar
Gompers A.L.
Su-Feher L.
Ellegood J.
Copping N.A.
Riyadh M.A.
Stradleigh T.W.
et al.
Germline Chd8 haploinsufficiency alters brain development in mouse.
Nat Neurosci. 2017; 20: 1062-1073View in Article Scopus (108)
PubMed
Crossref
Google Scholar
Katayama Y.
Nishiyama M.
Shoji H.
Ohkawa Y.
Kawamura A.
Sato T.
et al.
CHD8 haploinsufficiency results in autistic-like phenotypes in mice.
Nature. 2016; 537: 675-679View in Article Scopus (151)
PubMed
Crossref
Google Scholar
Schafer S.T.
Paquola A.C.M.
Stern S.
Gosselin D.
Ku M.
Pena M.
et al.
Pathological priming causes developmental gene network heterochronicity in autistic subject-derived neurons.
Nat Neurosci. 2019; 22: 243-255View in Article Scopus (98)
PubMed
Crossref
Google Scholar
Lewis E.M.A.
Meganathan K.
Baldridge D.
Gontarz P.
Zhang B.
Bonni A.
et al.
Cellular and molecular characterization of multiplex autism in human induced pluripotent stem cell-derived neurons.
Mol Autism. 2019; 10: 1-23View in Article Scopus (6)
PubMed
Crossref
Google Scholar
ADHDとASDのコンソーシアム神経科学ENIGMA
注意欠陥・多動性障害と自閉症スペクトラムのコンソーシアム神経科学。ENIGMAの冒険
Martine Hoogman et al. Hum Brain Mapp.2022 Jan.
無料PMC論文詳細を表示
全文リンク
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8675410/
引用元
概要
神経画像は、過去数十年にわたって注意欠陥・多動性障害(ADHD)や自閉症スペクトラム障害(ASD)の人々の脳構造と機能を研究するために広く用いられてきた。これらの障害のニューロイメージング文献の主な欠点の2つは、採用されたサンプルサイズが小さいことと、使用された方法の異質性である。2013年と2014年に、ENIGMA-ADHDとENIGMA-ASDのワーキンググループがそれぞれ、これらの制限に対処するという共通の目標を持って設立された。ここでは、これらのワーキンググループがこれまでに完了し、現在も進行中のプロジェクトについて、説明的なレビューを提供する。ADHDとASDは、精神医学の診断分類が暗黙のうちに階層化されているため、疾患の発生にかなりの重複があるにもかかわらず、この分野はほとんど孤立した状態で発展してきた。ENIGMA-ADHDと-ASDのワーキンググループの協力は、この2つの疾患の神経画像研究をより密接にすることを目的としています。皮質下および皮質構造に関する症例対照研究の結果、効果量は小さいものの、皮質下容積がASDとADHDで同様に影響を受けることが示された。皮質構造の解析では、それぞれの障害に特有の差異が確認されたが、特に皮質の厚さにおいて、両者にかなりの重複があることも確認された。現在、脳の側方性、症例対照の予測、解剖学的不均一性など、別の研究課題を検証しているところである。ENIGMAの共同研究の目的を達成するために、新しいアイデアとフォローアップの分析が続けられ、より多くの画像診断法(拡散MRIと安静時機能MRI)、他の大規模データベースとの共同研究、二重診断のサンプルなどが含まれています。
キーワードADHD、ASD、ENIGMA、大脳皮質、ニューロイメージング、皮質下ボリューム。
1.はじめに
最も頻繁に診断される神経発達障害の2つは、注意欠陥・多動性障害(ADHD)と自閉症スペクトラム障害(ASD)であり、それぞれ子どもの5~7%、1~2.8%に発症する(Bairdら、2006;Faraoneら、2015;Thomas、Sanders、Doust、Beller、& Glasziou、2015;Xuら、2018)。両障害とも、生涯にわたって持続する可能性がある(Nylander, Holmqvist, Gustafson, & Gillberg, 2013)。ADHDは、年齢不相応な、不注意および/または多動性/衝動性の障害および持続的なレベルを特徴とし(米国精神医学会、2013)、ASDは、コミュニケーション、社会的相互作用スキルの障害、および反復および制限的な行動を特徴とする(米国精神医学会、2013)。2013年に『精神障害の診断と統計マニュアル』第5版(DSM-5)が出版されるまでは、ASDの診断があるとADHDの診断が除外されていました。したがって、両疾患の二重診断が公式に存在することはなかった。そのため、両疾患の研究分野は、ほとんど孤立して発展してきました。しかし、現在のDSM-5の診断ガイドラインでは、その二重診断が認められており、ADHDとASDの重複を研究する新しい研究分野が台頭してきています。近年の研究では、ADHDはASDの子どもに最もよく見られる併存疾患であることが示されており(Joshi et al., 2017)、ASDの子どもの40~70%がADHDを併存している(Joshi et al., 2017; Kaat, Gadow, & Lecavalier, 2013; Salazar et al., 2015)。ADHDの子どものうち、15~25%が臨床的に関連するASD症状を示し(Cooper, Martin, Langley, Hamshere, & Thapar, 2014; Kotte et al., 2013)、12%がASD診断の基準を満たしている(Jensen & Steinhausen, 2015)。また、大規模な双子研究により、ASD患者は一般集団よりもADHDである確率が非常に高いことが示された(OR = 22.33)(Ronald, Simonoff, Kuntsi, Asherson, & Plomin, 2008)。別の双子研究では、2つの障害のうちの1つと診断された子どもは、完全な併存診断がない場合でも、もう1つの障害の特徴を示すことが多いことが示されました(Ghirardi et al.、2018年)。
ADHDとASDは、母集団において両疾患が頻繁に共起することに加え、社会化やコミュニケーションの領域において、その病態や現象が一部重なる(例えば、[Antshel, Zhang-James, & Faraone, 2013])。臨床サンプルとコミュニティベースのサンプルの潜在クラス分析では、ADHD、ADHD+ASD、ASD+ADHD、ASDの4つの異なる患者群が解離し、真ん中の2つの患者群は、どちらかが臨床像を支配して、両方の障害の症状を示していました(van der Meer et al.、2012)。これらの知見から、ADHDとASDは同じ包括的な障害の異なる現れとみなすことができ、それぞれの診断は複雑な多変量形質の極限を表し、ほとんどの臨床例はADHDとASDの症状の様々な組み合わせを呈するという仮説が生まれた(Antshel, Zhang-James, Wagner, Ledesma, & Faraone, 2016)。単一の包括的な障害についての仮説を立てなくても、ADHDとASDの両方の中核的特徴-特に不注意と社会的欠陥-が重なり、ADHDとASDの特徴に関連する認知・行動特性において、完全ではないが部分的に重複したパターンが見られることはよく認められている(Rommelse, Geurts, Franke, Buitelaar, & Hartman, 2011; Truedsson, Bohlin, & Wålstedt, 2015; van der Meer et al, 2017)。このような仮説は、ADHDとASDを対立する表現型として捉えることを放棄することにつながるだろう(例えば、Mayes, Calhoun, Mayes, & Molitoris, 2012)。
この2つの障害に共通する背景を考えると、ENIGMAのADHDとASDのワーキンググループで行われた研究は、両疾患に特有の神経生物学的側面と共通する側面の両方の理解を深めるために利用されるかもしれません。
ADHDとASDの共通性を示すさらなる証拠は、遺伝子の研究から得られている。遺伝的には、ADHDとASDはともに複雑な障害であり、環境と遺伝的な感受性因子の影響を受けている。家族研究、双子研究、養子研究の結果は、ADHDとASDの両方が高い遺伝率(それぞれ75%と90%;Faraone & Larsson, 2019; Freitag, 2007)を持つことを示唆するように収束している。この遺伝性には,一般的な遺伝子変異と稀な遺伝子変異の両方が寄与しており(Sterstrom et al., 2019),この遺伝性の一部は,2つの障害で共有されている(Faraone & Larsson, 2019; Rommelse, Franke, Geurts, Hartman, & Buitelaar, 2010; Ronald & Hoekstra, 2011)。共通の遺伝子変異を考慮すると、大規模なゲノムワイド関連研究(GWAS)メタアナリシスにより、ADHDとASDは遺伝的に有意な相関があることが確認された(37%;Lee et al.、2019)。同様に、一般集団においても、ADHDとASDの遺伝的背景は、幼少期から思春期を通じて一部共有されていることが明らかになった(Stergiakouli et al.)強い効果量を持つ希少な変種は、比較的少数の人のみでASDまたはADHDを直接説明するが、そのような変種の多くは、それぞれの障害または両方に寄与することが知られている(例えば、Sterstromら, 2019)。また、そのような稀なリスクバリアントによってヒットする遺伝子の多くは、ASDとADHD(および他の神経発達障害;Cristinoら、2014;Schorkら、2019)が共有する生物学的プロセス(Bourgeron、2015)に収束すると思われます。これらのプロセスには、クロマチンリモデリングと転写、タンパク質合成と分解、シナプス受容体と細胞接着分子、足場タンパク質に関与するものが含まれる(Luo, Zhang, Jiang, & Brouwer, 2018)。
1.2.ENIGMA-ADHDとENIGMA-ASDの設立前のADHDとASDの生涯にわたる神経イメージング
過去数十年間、多くの神経画像研究により、ADHDやASDの人々の脳の構造と機能が調査されてきた。ADHDの文献の中で、ほとんどの研究は、子供だけでなく、ADHDの成人でも、多種多様な脳領域にわたる構造的な症例対照差を示した(Faraoneら、2015年;Frankeら、2018年)。さらに、集団におけるADHDの症状評価は、例えば大脳皮質の厚みと負の相関があることがわかった(Mousら、2014;Shawら、2011)。症例対照研究に基づく計5つのメタアナリシスでは、ADHDに関連する脳構造に共通する差異を明らかにしようとしている(Ellison-Wright, Ellison-Wright, & Bullmore, 2008; Frodl & Skokauskas, 2012; Nakao, Radua, Rubia, & Mataix-Cols, 2011; Norman et al, 2016; Valera, Faraone, Murray, & Seidman, 2007)。それらのメタアナリシスで最も一貫した結果は、対照群と比較して、患者の線条体の(一部の)体積が減少していることであった。これら5件の研究のうち2件は、ADHD患者と対照者の線条体の構造的差異が年齢の上昇とともに減少し、覚醒剤治療が脳体積の差異を正常化する効果と関連していることを報告している(Frodl & Skokauskas, 2012; Nakao et al.)この研究は、ADHDの病態における線条体の役割を強調するものであった。これらのメタアナリシスの限界は、併存疾患、薬物使用、年齢など、同定された脳の違いに対する個人変数の役割を調査する能力に限界があること、寿命の軌跡を見ることができないこと、などである。脳体積の縦断的研究は、ADHDの個人の脳の成熟の遅れを示唆しているが、成人期へのADHDの再発と持続に対する意義はまだ不明であるため、このような寿命の軌跡はADHDにおいて興味深いものである(Shawら、2007、2011)。
ASDに関する研究の多くは、皮質下部の脳の異常の役割に焦点を当てている(Amaral, Schumann, & Nordahl, 2008)。より大きな(Turner, Greenspan, & van Erp, 2016)、より小さな(Sussman et al,2015)の線条体構造の体積が報告されている一方、ASDでは平均頭蓋内体積、総灰白質、皮質厚が高いことも以前に報告されており(Fombonne, Rogé, Claverie, Courty, & Frémolle, 1999; Haar, Berman, Behrmann, & Dinstein, 2016)、前頭葉と側頭葉においてより特異な皮質の影響(Foster et al.2015; Zielinski et al.2014) があることが分かっています。前頭葉と線条体の体積の変化と前頭葉-線条体結合の乱れは、ASDの実行機能欠損説の重要な構成要素である(Di Martino et al, 2011; Langen et al, 2012)。一方、特に小児期における扁桃体積の異常は、ASDの社会性理論に関連すると考えられる(Baron-Cohenら, 2000)。しかし、これらの脳の形態的な違いの方向性や効果の大きさに関しては、神経画像に関する文献は一致していない(Nickl-Jockschatら、2012;Stanfieldら、2008)。ABIDEコンソーシアム(既存の13コホートからのMRIデータの公開データセット)の導入は、分析(Haarら、2016)がASDと脳形態学との非常に小さな局所的な関連性を示しただけで、おそらくASDにおける構造的差異の存在に完全に疑問を呈するように、既存の異質性の多くを減らすことができなかった。
いくつかの小規模な研究では、ADHDとASDの脳構造の違いと重複を調べており、側頭・頭頂領域(Brieberら、2007)、下前頭皮質(Geurts、Ridderinkhof、& Scholte、2013)、小脳、脳梁(Dougherty, Evans, Myers, Moore, & Michael、2016)、さらに白質(Ameisら、2016)における脳の構造変化と重複することが報告されています。ADHD、ASD、コントロールの子どもにおける白質構成の研究では、ASD症状や不注意の連続測定(ただしADHDの全症状ではない)と白質構成の指標、特に脳梁の間にトランスディグノスティックな関連が認められた(Aoki et al.、2017年)。ADHD、ASD、コントロールの症例における固有結合性の分析により、大規模なネットワークレベルで共有されたメカニズムと異なる根本的なメカニズムの両方のエビデンスが見出された。共有された結合性の変化は楔前部に見られ、一方、ADHD特有の次数中心性の増加は右線条体/淡蒼球で、ASD関連の次数中心性の増加は両側辺縁系領域で評価された(Di Martino et al.,2013)。全体として、ADHDとASDの両方の症例を含む、十分に検出力のあるクロス・ディスオーダー研究は明らかに不足している(Rommelse, Buitelaar, & Hartman, 2017)。さらに、数少ない既存の研究は、子供のみに焦点を当て、生涯にわたるADHDとASDの重なりはほぼ完全に不明なままである。
ADHDとASDの脳画像に関する既存の文献を総合すると、まだかなりのギャップがあり、改善の余地があることがわかる。主な欠点は、サンプルサイズが小さいことと、使用された手法に大きな異質性があることで、この2つが画像所見の再現を難しくしているようだ。これらの欠点の少なくともいくつかを改善する機会は、ENIGMAコンソーシアムによって促進されている。過去10年間、このコンソーシアムは、遺伝子と脳画像データセットを組み合わせるためのプラットフォームを提供し(Adamsら、2016;Hibarら、2015、2017;Steinら、2012)、統一された前処理と分析パイプラインを使用して、サンプルサイズを大幅に増やし、方法論の異質性を低減するとともに、ADHDとASDなどの異なる障害間の直接比較を可能にしました。ENIGMAの傘下には、2013年にADHD、2014年にASD研究のワーキンググループが設立され、以下のような狙いがあります。(a)研究間の所見の違いを引き起こす可能性のあるニューロイメージング研究の方法論的異質性を減らす、(b)ADHDとASDの個人の(新しい)特徴を特定する力を高める、(c)ADHDとASDの脳の特徴の生涯的な軌跡を横断的にマッピングする、(d) ADHDとASDの脳研究に関する専門知識を結集し世界中の力を合わせてADHDとASDにおける脳の理解を後押しする、です。両ワーキンググループの初期プロジェクトは、皮質下脳体積および皮質厚・表面積の解析に焦点を当てたものであった。
2.エニグマ-アドホックとエニグマ-アズディの研究から得られた主な知見。皮質下と皮質の測定
ENIGMA-ADHDの最初のプロジェクトでは、側坐核、扁桃体、尾状核、淡蒼球、海馬、視床、被殻などの皮質下構造、および頭蓋内総容積(ICV)をADHD患者と対照患者で比較しました。これらの脳領域体積は、ENIGMAが提供するプロトコルに基づき、FreeSurferソフトウェアを用いてセグメンテーションされた。すべての参加施設は、ENIGMAから提供されたプロトコルに基づき、生データのセグメンテーションとその品質チェックをローカルに行った。解析と品質管理に関する詳細な手順は、ENIGMA のウェブサイト(http://enigma.ini.usc.edu/protocols/imaging-protocols/)に掲載されている。得られた出力は、各サイトからENIGMA-ADHDのコーディネーターに送られた。解析は、23の施設で収集された、合計1,713人のADHDの症例と1,529人の対照者(年齢範囲は4~63歳)を含むデータに対して行われました。横断的メガ解析では、サンプル全体と、小児(15歳未満)、青年(15~21歳)、成人(21歳以上)に分けて症例-対照の差異を検討した。年齢、性、ICVを固定変数、部位をランダム変数とした線形混合モデルが実行された。全サンプルの結果は、側坐核(コーエンのd=-0.15)、扁桃体(d=-0.19)、尾状核(d=-0.11)、海馬(d=-0.11)、被殻(d=-0.14)、ICV(d=-0.10)の総体積に有意だが小さな差があり、ADHDの被験者はコントロールと比較して体積が小さかった(Hoogmanら、2017)。フォローアップのメタアナリシスでは、メガアナリシスの結果が確認された。年齢群を考慮した場合、症例対照の差は小児においてのみ有意であった。精神刺激薬の使用や現在の併存疾患の影響は見られず、ADHDの重症度(症状数)の検出可能な影響もなかった。しかし、これらの変数の利用可能性は全標本の25-50%とばらつきがあるため、後者の分析に対する統計的検出力は低かった。
ワーキンググループの2番目の主要な分析は大脳皮質を対象とし、Desikan-Killianyアトラス(Desikan et al., 2006; Hoogman et al., 2019)の34領域のセグメント化で皮質の厚さと表面積が計算されました。皮質下プロジェクトの完了以来、ENIGMA-ADHDは、皮質プロジェクトに含まれる4,180人-2,246人のADHDと1,934人の対照被験者を含む36サイトに成長した。その結果、ADHDの子供と対照者の分析では、前頭部、帯状疱疹、側頭部の表面積が平均して小さく、最も若い子供たちのグループで最大のケースコントロール効果の大きさが示された。最大の効果は、総表面積(d = -0.21)において認められた。皮質厚の値は,対照群と比較してADHDの子どもでは楔状回と側頭極で低いことがわかった。思春期と成人群では、表面積と厚みの差は見られなかった。ENIGMA-ADHDは、オランダのロッテルダムにおける小児集団研究であるGeneration-R研究(White et al., 2018)と連携し、不注意の症状が総表面積と負の相関を示し、最初のENIGMA-ADHDの分析で有意なケースコントロール差を示した2領域の表面積も負の相関を示したことが明らかになった。つまり、10歳の子どもの非臨床集団サンプルにおいても、尾側中前頭回と中側頭回における症例対照効果が検出されたのである。同様の傾向は他の領域でも見られ、例えばENIGMA-ADHDサンプルの1つ(n = 506)では、NeuroIMAGE(von Rhein et al., 2015)と呼ばれ、ENIGMA-ADHD解析からの有意領域は、家族性効果を調べるために症例とその無症状兄弟、無縁の典型発達対照者の間で比較された。対照群と比較して、罹患していない兄弟は、尾側中前頭回、外側眼窩前頭回、上前頭回、および総表面積の平均値が低かった。しかし、平均値は影響を受けた兄弟と有意な差はありませんでした(Hoogman et al.、2019)。兄弟は遺伝子の50%を共有しているため、これらのデータは、ADHDで観察される皮質の違いに家族性要因、遺伝子および/または共有環境が関与している可能性を示唆しています。
ENIGMA-ASDワーキンググループでは、皮質下体積および皮質厚/表面積の解析から得られた知見を共同原稿として発表した(van Rooij et al.2018)。従った前処理および解析パイプラインは、ADHDワーキンググループの解析で使用されたものと同一であった。この一次解析には、合計52施設が含まれ、ASD症例1,571例と対照群1,651例が含まれた。横断的なASDのメガ解析は、全年齢層にわたって行われた。淡蒼球(d = -0.08)、プタメン(d = -0.10)、扁桃体(d = -0.08)、側坐核(d = -0.13)の皮質下ボリュームに小さいが有意な欠損が認められた。皮質分析では、領域および総表面積に検出可能な差はなかった。しかし、ASD症例では前頭葉の皮質厚が厚く、側頭・後頭部の皮質厚が薄かった(d = -0.21~d = 0.2)。年齢による影響は、すべての皮質下および皮質所見において一様であり、ASD患者と対照者の差は思春期頃に明確なピークを示すが、成人では正常化することが示された。
3.皮質下および皮質指標における Adhd と Asd の症例対照研究間の重複と差異
ENIGMA-ADHDとASDのワーキンググループの皮質および皮質下解析の主な結果を検討すると、いくつかの共通かつ明確なパターンを容易に観察できる(Hoogman et al.2017; Hoogman et al.2019; van Rooij et al.2018 )。皮質下体積分析では、両障害とも対照群と比較して、被殻、扁桃体、側坐核の体積が同程度に減少しており、両コホートは驚くほど似ていた(図1および表1参照)。皮質厚の測定でも、ADHDとASDの出版物の間で、両疾患が側頭葉の皮質厚の低下と関連しているにもかかわらず、ASDのみが皮質厚の増加、特に前頭葉での増加を示したため、同等の効果を示した(図2参照)。ADHDの皮質分析から観察された最も強い効果は表面積であり、症例は対照群と比較して、有意に全体的に小さい表面積を示した(Hoogman et al.、2019)。これは、表面積の影響が観察されなかったASDの結果とは全く対照的である。これらの分析の限界は、ADHDコホートにおけるASDの症状/診断の完全なカバーがないことであり、その逆もまた然りである。
図1
ADHDとASDの両コホートにおける皮質下体積と総頭蓋内体積(ICV)のCohenのd効果量は、対照群と比較した場合。図はHoogmanら(2017)およびvan Rooijら(2018)から引用・翻案した。
表1
表1
ENIGMA-ADHDおよびENIGMA-ASDにおける(サブ)皮質解析の所見のまとめ
図2
図2
ADHDとASDの両コホートについて、対照群と比較した皮質指標のCohen's d効果量。図は、Hoogmanら(2019)およびvan Rooijら(2018)から引用・翻案した。を示したFreesurferセグメンテーションのみ...
ADHDとASDのワーキンググループの個別の分析における重複効果と固有効果のこれらのパターンに基づき、次の論理的ステップは、2つのワーキンググループの統合データでこれらの分析を繰り返すことであった。ENIGMAの異なるワーキンググループで共通の解析パイプラインに基づくメガ解析アプローチの主な利点の1つは、データの比較可能性である。最近のクロス障害解析では、3つの障害間で共有される効果および固有の効果を調べるために、ENIGMA-ADHD、ENIGMA強迫性障害(OCD)、およびENIGMA-ASDワーキンググループからの脳構造データを組み合わせた(Boedhoe et al.、2019)。解析対象は、ADHDの2,271人、ASDの1,771人、OCDの2,323人、対照の5,827人で、年齢別に小児(12歳未満)、青年(12~17歳)、成人(18歳以上)に細分化されました。その結果、ASDとADHDの影響は小児期に最も強く重なり、ADHDとASDの症例はともに皮質下領域の体積が全体的に低く、前頭葉と側頭葉の皮質厚が低いことが示された。しかし、効果の大きさは小さく、ほとんどが多重比較の補正に耐えるものではなかった。ADHD、ASD、OCDの症例を比較すると、ICVの総量に最も大きな差が見られた。ASDの子どもは、対照群とADHDやOCDの症例の両方と比較して、より高い平均ICVを示したのである。海馬の体積は、ADHDの子どもではOCDの子どもと比較して小さく、OCDとASDの成人では対照群と比較して小さかったが、この差はいずれも多重比較補正に耐えるものではなかった。皮質の厚さについては、ADHDの成人はASD、OCD、健常対照者と比較して、眼窩前頭部、下前頭部、帯状回の皮質の厚さが小さかった。これらの分析を総合すると、それぞれの障害に特有の皮質の特徴があることが示されたが、特に皮質の厚さを考慮すると、2つの障害の間にかなりの重複があることもわかった。皮質下体積はASDとADHDの両方で同様に影響を受けていたが、すべての年齢区分での効果の大きさは非常に小さいままであった。
4.enigma-adhd と enigma-asd における二次プロジェクト
ENIGMAの精神に基づき、共同研究内の研究者は、別の研究課題に取り組むため、あるいは新しい分析戦略や手法をテストするために、収集したデータについて追加分析を行うことが奨励されています。ENIGMA-ADHDとENIGMA-ASDには、重複する目的を持つ4つのプロジェクトがあります。これらは、ラテラリティ、機械学習、層別化、および仮想組織学に関するプロジェクトである。ENIGMA-ADHDの中では、さらに小脳に焦点を当てたプロジェクトも実施されました。これらのプロジェクトは様々な段階にあり、査読後に出版されたか、査読なしのプレプリントとしてbioRxivに投稿され査読結果を待っているか、あるいはまだ解析と執筆の段階にある。表2に各プロジェクトの概要を示す。
表2
表2
ENIGMA-ADHDおよびASDワーキンググループによる発表済みおよび進行中の作業の概要
4.1.ENIGMA-ADHDとENIGMA-ASDにおけるラテラリティ解析
ADHDとASDのワーキンググループにおけるラテラリティプロジェクトは、罹患者集団における左右の構造的な脳の非対称性の変化を明らかにすることを目的としています。ADHDの文献におけるこれまでの知見とは対照的に、ENIGMA-ADHDのラテラリティ研究では、尾状核における非対称性の証拠が示されなかった。小児、青年、成人における症例対照差の他のすべての脳非対称性解析では、多重比較補正に耐える有意な結果を示さなかった(Postema, Hoogman, et al.)前頭、帯状、下側頭部の皮質厚の非対称性の程度の変化は、ENIGMA-ASD laterality研究(Postema, van Rooij, et al., 2019)において観察され、ASDの被験者はすべての領域で非対称性の減少を示した。唯一の例外は左方被蓋の非対称性であり、ASDでは有意に増加した。
4.2.ENIGMA-ADHDとENIGMA-ASDにおける機械学習結果
皮質下と皮質の両方のデータは、ENIGMA-ADHD(Zhang-Jamesら、2019)内の機械学習によって症例対照状態を予測するために使用された。サポートベクターマシン、ランダムフォレスト、K-Nearest Neighbors、およびgradient boosting分類器を用いて、サンプルの85%でモデルを推定し、サンプルの残りの15%を使用してモデルの精度をテストしました。その結果、ADHDと対照被験者の間で統計的に有意な識別が可能であることが示された。しかし、予測精度は大人で67%、子供で66%と比較的低いものであった。最も有益な構造は、当然のことながら、ENIGMA-ADHDデータの主解析で有意な症例-対照差を示した構造と重なる。ICV、表面積、およびいくつかの皮質下体積(Hoogmanら、2017;Hoogmanら、2019)。孤立した症例対照差を調べるのではなく、機械学習分析ですべての脳データを組み合わせることで、成人群は有意な症例対照差を示したことは心強いことである。子どものデータに基づくモデルは、成人サンプルにおけるADHDの状態を有意に予測し、その逆も同様であったことから、機械学習アルゴリズムが検出した構造的MRIの違いは、子どもと成人に類似していることが示唆された。予測値を上げるためには、より大きなサンプルサイズ、または他のデータモダリティ(例えば、拡散MRI、安静時機能的MRI)を追加することが必要であるかもしれない。あるいは、ASDのような他のコホートと機械学習の結果を統合することによっても達成されるかもしれない。
ASDワーキンググループで進行中の研究でも、同じ機械学習ストラテジーが適用されている。解析の結果、予測精度の点ではほぼ同様の結果が得られ、予備的な精度は60%程度と低かった。しかし、ENIGMA-ADHDとASDのコホートを学習セットでマージしたときに、顕著な結果が生じた。予備的な結果では、学習セットにENIGMA-ADHDのデータも含めると、予測セットにおけるASDの診断に関する予測精度が有意に高くなることが示された。これは、この場合、対照群の数が2倍になることが一因と考えられるが、第3の診断カテゴリー(この場合はADHD)の例を学習することで、アルゴリズムが他の2つ(ASDと対照群)をより明確に解離できる可能性があるためであると考えられる。これらの予備的知見は、グループレベルでの脳の違いの効果量が小さくても、これらの形態的特徴には、高度なアルゴリズムが症例と対照群を解離させるために利用できる多くの情報があることを示しています。さらに、一般的な神経発達研究、特にENIGMAコンソーシアムにおいて、異なる疾患を研究する科学者間の協力の重要性を浮き彫りにしています。
4.3.ENIGMA-ADHDとENIGMA-ASDにおける層別化分析
ENIGMA-ADHDと-ASDの両ワーキンググループが発表した脳の一次構造解析から得られた重要な観察結果は、任意の脳指標における高いグループ内分散であり、グループ間差の検出を困難にしていることだった(Hoogman et al.2017; Hoogman et al.2019; van Rooij et al.2018 )。我々は、集団レベルでは、異なる神経解剖学的プロファイルが存在し、それはより均質な神経解剖学的サブグループに対応するであろうという仮説を立てている。したがって、ENIGMA-ADHDおよびENIGMA-ASDの重要な副次的目標は、脳の構造データをサブグループに層別化し、これが症例-対照比較にどのように影響するか、またこれらのサブグループが固有の神経生物学的プロファイルを有するかどうかを調査することである。
皮質下体積の層別化の可能性を検討するために、2段階の解析を行った。まず、すべての被験者の皮質下体積を探索的因子分析(EFA)に入力し、9つの皮質下体積をいくつかの基礎因子に要約するために使用した。次に、これらの因子は、皮質下脳プロファイルにおいて異なる患者および対照集団内の特定のサブグループが存在するかどうかを確認するために、地域検出クラスタリング分析で使用された(Liら、2019年)。現在進行中の研究では、ENIGMA-ADHDとASDの両データセットについて同様の分析が行われている。
EFAの結果、皮質下体積の変動は、男性では線条体、大脳辺縁系、視床の3つの主要因に集約されることが示されました。この因子構造は、症例と対照の両方に基づいており、ADHDコホートとASDコホートの間で安定していた。また、男女間、女性の小児・青年・成人間で若干の差異が見られた。コミュニティ検出分析の結果、コホートはその後4つの別々のプロファイルに層別化でき、それぞれ線条体、大脳辺縁系、視床の各因子のユニークな負荷パターンに対応することが示された。さらに、これらのコミュニティは、ADHDとASDの解析の間で安定しており、コミュニティ間の分布は、症例と対照の間で同等であることが確認された。このことから、4つのコミュニティそれぞれにおける症例-対照の差異を見ることができた。ADHDとASDの症例-対照比較の効果量は、コホート全体よりも、4つの明確なコミュニティ内で有意に高かった。また、この研究は、コミュニティ構造が生涯にわたって変化し、成人期に1つのコミュニティが消滅する可能性があることを示した。この変化は、神経解剖学的多様性が年齢とともに減少する可能性を示唆している。ADHDとASDの研究において、神経解剖学的構成における性差は非常に重要なテーマであるため、現時点では、ADHDとASDのコホートともに女性が少なすぎて、性別を考慮した十分に検出力のあるコミュニティ検出分析を行うことができませんでした。ENIGMAコホートのさらなる発展により、これらの解析が近いうちに可能になることを期待している。
本稿執筆時点ではまだ予備的な知見であるが、すべての結果は我々の主要な仮説を支持している。すなわち、脳構造に基づく集団内には比較的均質なサブグループが存在すると考えられ、これらのサブグループを考慮することにより、我々のケースコントロール解析の効果量を有意に増大させることができると考えられる。
4.4.ENIGMA-ADHD、ENIGMA-ASD、その他4つの疾患ワーキンググループのバーチャル組織学解析
神経画像研究により、異なる精神疾患の患者内において、大脳皮質の形態(厚さと表面積)に強固な違いが観察されている(Thompsonら、2020)。しかし、このような大脳皮質の巨視的な構造の違いの根底にある神経生物学的な変化はよく分かっていません。ENIGMA-ADHDおよびENIGMA-ASDコホートにおける群差のプロファイルについてさらなる洞察を得るために、我々は仮想組織学アプローチ(Patelら、2018;Shinら、2018)を採用した。これは、Allen Human Brain Atlasからの遺伝子発現の領域間プロファイルと、Desikan-Killianyアトラスの34領域にわたる皮質の厚さの違いにおける領域間プロファイルを関連付けることを伴う(Desikan et al.)仮想組織学により、皮質厚の大きな群間差を示す領域で、どの細胞タイプ(例えば、錐体、介在ニューロン、アストロサイト、ミクログリア、オリゴデンドロサイト)が濃縮されているかを推測することができるかもしれません。仮想組織学プロジェクトの目的は、6つの精神疾患(ADHD、ASD、双極性障害、OCD、大うつ病性障害、統合失調症)においてこのアプローチを採用し、これらの疾患における皮質厚のグループ差に共通または固有の神経生物学を特徴付けることである。
ENIGMA-ADHDの追加プロジェクトの1つは、ADHDにおける小脳の特異的な神経解剖学を調査することを目的としたものである。ワーキンググループの4つのコホートの共同イニシアチブ(Shawら、2018)は、小脳の様々な領域をセグメント化し、症例と対照のこれらの領域における成長軌跡を特定しました。1,656人の被験者(患者と対照者)のサンプルにおいて、髄質(小脳白質)の成長における診断上の差異が浮かび上がった。特に、ADHDの症例では、幼児期には定型発達群に比べ成長が遅く、幼児期後半には逆転することが示された。
5.5.エニグマ-アドホックとエニグマ-ASDの長所、課題、限界
ADHDとASDの脳画像分野におけるENIGMAコンソーシアムの主な強みは、既存のデータを共有することであり、その結果、この分野の経験と専門性がさらに統一されたことである。メタアナリシスを超えて、個々のテスト統計値を共有することで、他の方法では不可能だった、より洗練された分析を行うことができました。
ENIGMAのワーキンググループでは、参加メンバー全員が署名した覚書に記載された、明確なデータ管理、執筆、出版ガイドラインを設けています。これにより、すべての新しい分析のプロセスと結果の両方において、すべてのワーキンググループメンバー間の透明性が確保されます。ワーキンググループのオープンな性質は、新しいサイトやPIが定期的に参加するという雪だるま式の効果をもたらし、その結果、新しい分析ごとにより多くのデータが得られるようになります。ENIGMAの二次提案に関する方針は、すべてのワーキンググループメンバーが二次提案を提出できることを定めており、これはENIGMA-ADHDとASDワーキンググループの異なるメンバーによって先導された、多くの興味深く重要な貢献につながったのです。前述したように、ENIGMAコンソーシアム(http://enigma.ini.usc.edu/protocols/imaging-protocols/)内の専用メソッドワーキンググループによって開発された、画像解析のためのオープンアクセスプロトコルの共有も強みとなっています。これらの詳細なプロトコルは、FreeSurfer 5.3を用いた定義された解剖学的領域への脳のセグメンテーションや品質管理手順を含み、異なる方法を使用することから生じるばらつきを取り除くのに役立ちます。一般に、症例-対照差を計算するために使用される統計モデルも、ワーキンググループ間で類似している。R の nlme パッケージを用いた混合線形モデルは、年齢、性、症例対照の状態を固定変数とし、「部位」をランダム因子として実装されている。ワーキンググループによって異なるが、より良いモデル適合を得るために、固定因子の交互作用をモデルに追加することもある。これはワーキンググループによって異なる。解析する脳指標によっては、グローバルヘッドサイズを考慮した共変量が追加される。皮質下体積プロジェクトでは、頭蓋内体積を共変量として追加し、皮質表面積プロジェクトでは、総表面積を共変量とした場合と共変量なしの場合で解析が行われた。
このような努力にもかかわらず、いくつかの課題と限界が残されています。ワーキンググループが直面する重要な困難の1つは、データそのものの性質である。レガシーデータとは、過去の研究や出版物から得られた既存のデータを指し、本質的にデータ収集や表現型決定のプロトコルの調和がとれておらず、さらに新しい研究に比べてフォローアップデータの取得が困難である。特に、原著論文の著者が退職し、新しい職位に就いた施設では、ローカルに保存された生の画像データへのアクセスを必要とする新しい解析を繰り返し組織することが困難であることが証明されたことがある。同様に、多くの異なる施設の人口統計学的および表現型データは、数十年にわたり異なる年に、異なるツールや方法を用いて、異なる目標を念頭に置いて取得されたものである。このため、例えばコホート内の症状評価にはかなりの異質性があり、併存疾患の評価にも一貫性がない。ENIGMA-ADHDでは、現在、55%の患者さんについて、ADHDの症状評価尺度に関する情報を入手することができます。58%の患者さんについては、併存疾患に関する情報があり、44%と66%の患者さんについては、それぞれ生涯の覚せい剤使用と現在の覚せい剤使用に関するデータを入手することが可能です。ENIGMA-ASDでは、コホートの27%で自閉症診断観察尺度(ADOS)のデータがあり、共存症に関する情報が15%、現在の薬物使用に関する情報が49%あります。既存の出版物では、次元的表現型アプローチではなく、カテゴリー的(症例、対照)アプローチに歴史的に焦点が当てられているため、ENIGMA-ADHDとASDで利用できる表現型の関連性の深さが制限されています。我々が直面している困難のもう一つの例は、DSM-IVからDSM-5への変更に見出すことができる。DSM-5が出版される以前は、ADHDとASDを同時に診断することはできませんでした。そのため、多くの古いサンプルは、当時は余分なものと考えられていたため、ADHD/ASDの併存性データの取得を見送ったのです。ADHDコホートにはASDの症状が共存している可能性が高く、またその逆もあることから、2つのコホート間の脳構造変化の重複が増加した可能性がある。これらのレガシーサンプルの元の患者や研究者とさえも再接触することはしばしば実行不可能であり、ENIGMA-ADHDおよびASDコホートにおける利用可能な表現型データの深さと忠実性を制限している。
6.エニグマ-アドヘンダーとエニグマ-アスドのフォローアップ。共同研究の枠を超えた成果
ENIGMA-ADHDグループとENIGMA-ASDグループの研究は、様々なフォローアップ分析を触発しました。ENIGMA-ADHDワーキンググループは、ADHD患者のICVと皮質下領域の体積減少を発見した。しかし、このような変化が疾患の表現型にどのように寄与しているかは、まだほとんど分かっていない。ADHDと脳体積はともに高い遺伝性を有することから、ADHDの病態の根底にある遺伝的変異が脳体積の変動にも影響を及ぼす可能性が示唆されている。最近の研究では、ADHDのリスクとADHDに関与する脳体積の間の遺伝的共分散を調査した。グローバルなゲノムワイドレベルで、ADHDとICVの間に有意な負の遺伝的相関が見つかり、これは、より小さなICVに関連する変異体がADHDリスクの上昇と関連していることを意味している(Klein et al.)これは、ADHDの個体が対照群と比較してICVが小さいという表現型の観察に似ている。単一バリアントおよび遺伝子全体レベルでは、いくつかの有意な遺伝子座がADHDリスクおよび脳体積の両方と関連していた(Kleinら、2019)。同様の遺伝子重複解析により、皮質構造の変異がADHDと遺伝的に相関していることが明らかになった(Grasbyら、2020)。より具体的には、ADHDとICVと高い相関を持つ脳の表現型であるグローバル表面積との間に、有意な負の遺伝的相関があることが明らかになった(Grasby et al.、2020)。このようなゲノムワイドな統合解析は、脳構造の変化がADHDの疾病病因に関与する生物学的メカニズムに関する新たな仮説の構築に役立つと考えられる。ADHDとICVの遺伝的相関は、同様の方法を用いた統合失調症(Adamsら、2016;Frankeら、2016)、大うつ病性障害(Wigmoreら、2017)、ASD(Groveら、2019)などの他の精神疾患の研究でも見られなかったことから、この疾患に対する特異性があることが示されました。Radonijcら、2020(本号)による関連する分析では、ENIGMAワーキンググループが調査したいくつかの障害において、症例-対照の構造的脳差異が大きいものは、共通の遺伝子バリアントのアーキテクチャにおいてもより類似性を示すことが示された。
ADHD-ENIGMA解析の皮質下領域の症例対照標準化平均差を用いた解析において、Hessら(Hess, Akutagava-Martins, Patak, Glatt, & Faraone, 2018)は、ADHD関連容積減少と有意に相関する生物パスウェイとして、アポトーシス、酸化ストレス、オートファジーの3つの遺伝子発現プロファイル(Allen Human Brain Atlas)の報告をしました。これらの相関は、ADHDの子どもでは強く、有意であったが、成人では見られなかった。ENIGMA-ADHDの皮質データも含むその後の解析で、同じグループは、ADHDに関連する体積減少がアポトーシス、オートファジー、神経発達遺伝子経路と、ドーパミン作動性ニューロン、アストロサイト、オリゴデンドロサイト、神経前駆細胞の領域存在と関連していることを発見しました(Hess、Rodonji、Patak、Glatt、&Faraone、2019年)。これらのデータは、ADHDに見られる選択的な脳領域の脆弱性は、ADHDに関連する容積変化を示す領域と示さない領域の間の細胞組成と構成的な遺伝子発現の違いによる可能性を示唆している。
ENIGMA共同研究の目的を達成するために、特にADHDとASDにおける神経画像研究の力を高めるために、大きな前進がありました。これらの共同研究で発表された研究は、それぞれの疾患のニューロイメージングの分野で、圧倒的に大きなサンプルサイズを含んでいます。まず、これにより、厳格な方法(split half validation, Mackey et al., 2018など)で堅牢な症例対照差を特定することが可能になりました。第二に、横断データの限界を意識する必要があるが、サンプルの年齢範囲が広いため(ADHD:4-63歳、ASD:2-64歳)、ライフスパンにわたるケースコントロールの差異を検討することが可能である。また、サンプルサイズが大きいため、年齢群別解析が容易になり、ライフスパンにおける脳の違いの発達について、より具体的な仮説を立てることができるようになった。第三に、これらの共同研究から派生した追加プロジェクトは、ADHDとASDの脳との関連についての理解を深めるために専門知識を結集するという我々の目的が達成され、常に新しいアイディアが補充されていることを示す強力な例である。共同研究グループ内だけでなく、他の研究者も刺激を受けて、関連する分野から、障害に関連する脳の違いについてさらに多くの知識を生み出すための研究課題を打ち出しています(Hess et al.2018; Klein et al.2019)。現在、追加解析の最初の論文が発表されていますが、多くの作業はまだ進行中であり、さらに多くのコホートが私たちのワーキンググループに参加しています。したがって、これらの取り組みからより多くのアウトプットが得られることを期待している。最後に、ENIGMA-ADHDとASDで使用された前処理と解析パイプライン、およびサイトごとの解析結果の多くを公開することで、方法論の異質性を低減することを目指しました。これにより、研究間の結果のばらつきの量と範囲について前例のない洞察が得られ、新しいサンプルを容易に比較することができる明確な基準値が初めて確立されました。
7.1.ワーキンググループでの追加データ収集
今後の作業は、新たな分析の実施と追加データの取り込みに専念することになる。ENIGMA-ADHDグループと-ASDグループは、現在、拡散テンソル画像(DTI)から得られる構造的結合データの解析に取り組んでいる。DTIプロジェクトでは、脳容積の解析と同様の解析を行いますが、孤立した脳領域のテストにとどまりません。ここでも、すでに成功したENIGMAが提供する処理パイプラインを利用することができます(Favre et al.2019; van Velzen et al.2019; Villalón-Reina et al.2019).ENIGMA-ASDコホート内では、安静時fMRIデータも解析され、EU-AIMSコホートなどの既存のデータセットとプールされ、標準的な機能的関心領域にパーセレーションされ、脳機能(ディス)結合性のグラフ理論解析に使用されています。ENIGMA-ADHDおよびASDワーキンググループの既存の脳構造データにDTIおよび安静時fMRIデータを追加することは、これらのENIGMAワーキンググループの最も重要な長期目標の一つである真のマルチモーダル画像データ統合への重要なステップとなるものである。ADHDとASDに関する文献と同様に、私たちが現在得ているすべての知見は、利用可能なすべての画像モダリティにおいて神経の変化が見られることを圧倒的に示しています。現在のところ、構造的、機能的、および結合的なデータを組み合わせた大規模なデータセットが存在しないため、これらの異なるモダリティで得られた知見がどのように相互に関連しているかはほとんど不明である。ADHDとASDの神経生物学的モデルをより完全なものにするためには、マルチモーダルデータの統合が鍵となる。
ADHDとASDの重なりや違いについて知るためには、両疾患の二重診断を認めているサンプルに注目したい。強み、課題、限界の項で述べたように、現在のADHD/ASDに関する研究のほとんどは、データ収集のためにもう一方の障害を除外している。真の複合診断を受けた第3のグループを加えることは、ADHDとASDのクロス・ディスオーダー分析を大いに強化し、ADHDとASDの遺伝的・神経的相関がどのように相互作用し、それが生涯にわたって疾患表現型の発達にどのように影響するかを調べる助けとなる。
7.2.他のコンソーシアムとの連携
本稿で述べたように、ADHDとASDは、より広範な表現型の異なる現れと見ることができる。この見解はさらに、複数の神経発達障害、特にOCDとトゥレット症候群を含むように拡張することができます。これらの障害間の併存性や認知・神経変化における大きな重複は、神経発達障害の標準的なカテゴリー別疾患分類を見直す必要があるかもしれないという仮説につながり、ADHD、ASD、OCD、トゥレット症候群は実際には衝動性-強迫性連続体にあり、機能障害脳回路に収束する重複した病因を共有しているかもしれません(Clark、Cuthbert、Lewis-Fernández、Narrow、& Reed、2017;Huisman-van Dijk, van de Schoot, Rijkeboer, Mathews, & Cath, 2016)。ENIGMAコンソーシアムの主要な次のステップは、ADHDとASDだけでなく、ENIGMA-OCDとトゥレット症候群を含む神経発達障害ワーキンググループ全体でマルチモーダル画像比較を統一することを目的としている。
さらに、ADHDとASDの両方について、縦断的サンプルの脳データを組み合わせることは大きな関心事である。以前報告されたADHDの成熟の遅れ、ENIGMA-ADHDの成人サブ解析における症例対照差の不在、あるいはASDの思春期に限定された変化と障害の提示の変化はすべて、ADHDに関連する脳の変化のライフスパン的な視点をより詳細に、より良いデータで見ることを支持するものである。さらに、ASDの発症や治療成績に関連する初期のバイオマーカーは、臨床界にとって非常に大きな価値を持つものでしょう。現在、この目的のために、EU-AIMSプロジェクト(Murphy & Spooren, 2012)の一環として、中規模の多施設縦断データが収集されており、ENIGMA-ASDの協力パートナーとして、縦断構造脳解析の両方を調査できる可能性があるほか、EEGとアイトラッキングデータと同様に広範な行動表現型も含まれており、ENIGMA画像所見をより幅広い行動および生物学的指標に関連付ける新しい機会が提供される予定です。
ADHDとASDの双方に関連する行動は、単なる患者集団に固有のものではなく、一般集団の中に連続的な形質として存在する(Asherson & Trzaskowski, 2015; Bralten et al, 2018)。つまり、ADHDとASDに関連する遺伝的特徴と神経画像的特徴の両方が、母集団サンプルにおいても分布形質として見出される可能性があるということである。ENIGMAの解析結果と集団ベースの脳データの解析を組み合わせることで、ADHDの皮質解析の事例で成功している(Hoogman et al.、2019)。このような精神医学的特徴の全領域にわたる脳の特徴をよりよく把握することができるので、このような分析を広げていきたいと考えています。
最後に、ENIGMA-ADHDとASDの中で遺伝データと神経画像データを組み合わせるには、理想的には同じ被験者からの遺伝データと画像データが必要で、どの遺伝要因が今回見つかった脳の特徴に寄与しているかを調べる必要があります。残念ながら、ENIGMA-ADHDとASDのサンプルは、そのような解析を行うにはまだ少なすぎる。しかし、他の共同研究の複数の大規模データベースのデータを組み合わせることで、例えばADHDリスクの遺伝的重複やADHD関連の脳体積に関わる遺伝的要因に関するプロジェクト(Klein et al.、2019)など、新しい情報をもたらすことも分かっています。将来的には、このような種類の解析をより多く行い、他の研究者が興味深い仮説を立てることを奨励・勧誘することを目指します。
Paul M. Thompsonは、Biogen, Inc.の研究助成金により一部支援を受けています。(米国ボストン)から、この原稿とは関係のない研究のために研究助成金を受けた。Odile A. van den HeuvelはBenecke社から講演謝礼を受け取りました。David Coghillは、Lilly、Medice、Novartis、Oxford outcomes、Shire、Viforpharmaの顧問またはコンサルタントを務めています。彼はJanssen McNeil, Lilly, Medice, Novartis, Shire and Sunovianから会議支援や講演料を受け取っている。Lilly & Shireが実施する臨床試験に参加している/参加したことがある。今回の研究は、上記の助成金や関係とは無関係である。Jonna Kuntsiは、and Medicineが主催する教育イベントで講演を行っています。すべての資金はKing's College Londonが受け取り、ADHDの研究に使用されています。Paulo Mattosは、過去5年間にJanssen-Cilag、Novartis、Shireのスピーカービューローおよび/またはコンサルタントとして活動し、これらの企業から科学的会合に参加するための旅行賞も受け取りました。Mattos博士が会長を務めるADHD外来プログラム(Grupo de Estudos do Déficit de Atenção/Institute of Psychiatry)もNovartisおよびShireから研究支援を受けています。資金提供元は、研究のデザインと実施、データの収集、管理、分析、解釈、原稿作成、レビュー、承認には一切関与していません。Tobias Banaschewskiは、Lundbeck、Medice、Neurim Pharmaceuticals、Oberberg GmbH、Shire、およびInfectopharmの顧問またはコンサルタントとしての役割を担っています。また、Lilly社、Medice社、Shire社から学会支援や講演料を受け取っている。Hogrefe, Kohlhammer, CIP Medien, Oxford University Pressからロイヤリティを受け取ったが,本研究はこれらの関係とは無関係である。Katya Rubiaは武田薬品工業から別のプロジェクトで助成金を受けた。Jan HaavikはLilly、Novartis、Janssen Cilagから講演料を受け取っている。Stephen V. Faraoneは、Tris, Otsuka, Arbor, Ironshore, Shire, Akili Interactive Labs, VAYA, Ironshore, Sunovion, Supernus and Genomindから収入、収入見込み、旅費継続教育支援、研究支援のいずれかを受けている。所属機関とともに、ADHDの治療におけるナトリウム-水素交換阻害剤の使用に関する米国特許US20130217707 A1を取得している。Kerstin Konradは、Medice、Lilly、Shireから講演料を受け取っている。Josep-Antoni Ramos-Quiroga Josep-Antoni Ramos-Quirogaは過去5年間にEli-Lilly, Janssen-Cilag, Novartis, Shire, Lundbeck, Almirall, Braingaze, Sincrolab, Medice and Rubióでスピーカー事務局に所属し、および/またはコンサルタントとして活動していた。また、Janssen-Cilag, Medice, Rubió, Shire, Eli-Lilly から、精神医学の学会に参加するための旅行賞(航空券+ホテル)を受賞している。彼が学科長を務める精神医学教室は、過去5年間に以下の企業から無制限の教育・研究支援を受けている。エリ-リリー、ルンドベック、ヤンセン・シラグ、アクテリオン、シャイアー、フェレール、オリゾン、ロシュ、プシャス、ルビオ。Klaus-Peter LeschはEli Lillyのスピーカーを務め、Mediceから研究支援、Shireから渡航支援を受けたが、これらはすべて投稿論文以外のものであった。Pieter HoekstraはShire社から研究助成を受け、Shire社の諮問委員会の一員であった。Jan Buitelaarは過去3年間にJanssen Cilag BV, Eli Lilly, Medice, Shire, Roche, and Servierのコンサルタント/諮問委員会のメンバー/講演者であったことがある。彼はこれらの企業の従業員ではなく、またこれらの企業の株主でもありません。
その他、専門家の証言、特許、ロイヤリティを含む金銭的、物質的支援はありません。Barbara Frankeは、メディセから教育講演料を受け取っている。Susanne Walitzaは、過去5年間にEli-Lilly, Opopharmaから講演謝礼を受け取っており、彼女の外部専門活動および利害関係は、チューリッヒ大学www.uzh.ch/prof/ssl-dir/interessenbindungen/client/web のリンクの下で宣言されています。ダニエル・ブランデイスは、EUが資金提供するニューロフィードバック試験の無報酬科学コンサルタントを務めています。Georgii Karkashadzeは、サノフィ社およびピクファルマ社から論文の執筆料および講演料を受け取っている。Dr.Anagnostouは、Rocheおよび武田薬品からコンサルタントまたは諮問委員会のメンバーを務めており、Alva Foundation, Autism Speaks, Brain Canada, the Canadian Institutes of Health Research, the Department of Defense, the National Centers of Excellence, NIH, Ontario Brain Institute, the Physicians' Services Incorporated (PSI) Foundation, Sanofi-Aventis, SynapDxから資金提供、またAMO Pharmaからは現物研究サポートを受けている。また、American Psychiatric PressとSpringerからロイヤリティを、Wileyから編集謝礼を受け取っています。彼女の投稿はPONDネットワークを代表するものである。Dr.アランゴ博士は、アカディア、アボット、アムジェン、CIBERSAM、アリシア・コプロウィッツ財団、カルロス3世治療研究所、ヤンセン・シラグ、ルンドベック、メルク、カルロス3世治療研究所(欧州地域開発基金「A way of making Europe」の共同資金による)の顧問を務めたり謝礼や補助金を受けたりしています。「CIBERSAM、マドリード州政府 [S2010/BMD-2422 AGES]、欧州連合構造基金、欧州連合第7次枠組み計画(FP7-HEALTH-2009-2)助成契約。2.1-2-241909, FP7-HEALTH-2009-2.2.1-3-242114, FP7-HEALTH-2013-2.2.1-2-603196, and FP7-HEALTH-2013-2.2.1-2-602478), Otsuka, Pfizer, Roche, Servier, Shire, Takeda, and Schering-Plow, といった企業が含まれています。フライターク博士は、ASDに関する問題に関してDesitinのコンサルタントを務めている。
自閉症スペクトラム障害(ASD)における睡眠と行動の関係
自閉症スペクトラム障害(ASD)における睡眠と行動の関係:レビュー
Simonne Cohen et al. J Neurodev Disord.2014.
PMC無料論文
詳細を表示
全文リンク
引用元
概要
自閉スペクトラム症(ASD)児に睡眠問題が多いこと、睡眠不足が日中の問題行動を悪化させるという証拠があるが、そのような関係は研究・臨床の両面でほとんど注目されていない。ASDの挑戦的な行動を管理するための治療ガイドラインでは、睡眠について全く触れていないか、非常に限定的な説明しかされていない。さらに、最も深刻な睡眠障害や行動問題をしばしば経験する低機能自閉症の子どもたちには、限られた注意しか向けられていない。本論文では、ASDにおける睡眠障害の性質を説明し、低機能自閉症児の睡眠障害の複雑さを明らかにした。睡眠障害の性質に基づいてASD児をプロファイリングすることで、症状や行動のプロフィールを理解し(あるいはその逆)、より的を射た介入につながる可能性があることを提案している。本論文は、現在の知見の限界についての議論と、今後の研究にとって重要な領域の提案で締めくくられている。ASDの睡眠障害を治療することは、この脆弱な集団の日中の行動や家族機能を改善する大きな可能性を持っている。
キーワード自閉症スペクトラム、低機能自閉症、ASDにおける睡眠障害、ASDにおける睡眠の治療。
レビュー
自閉症スペクトラム障害(ASD)は、社会的コミュニケーションの障害と、反復的で固定化された興味や行動を特徴とする発達障害である[1]。自閉症は、子どもの発達に関する最も謎めいた障害の一つであり、有病率は2008年の88人に1人から2010年には68人に1人と劇的に増加している[2]。ASDの世界的な負担は現在のところ不明ですが、米国では、この疾患の年間社会的コストは1260億ドル、英国では340億ドルと最近予測されました[3]。このような経済的負担の増大により、ASD患者は臨床研究および治療法開発の最優先集団のひとつとされています。
現在、自閉症児の親の間で最も負担の大きい訴えのひとつが睡眠障害であり、40~80%以上の子どもが睡眠障害を経験しているのに対し、定型発達児(TYP)では25~40%となっています[4, 5]。発達期の子どもにおいて、睡眠はエネルギー保存、脳の成長、記憶の定着、認知など、複数の機能を果たしている[6]。日常機能における睡眠の重要性を考えると、ASDの個人における睡眠の乱れの結果は、潜在的に深刻である。最近の研究では、睡眠不足がASDの中核的症状(反復行動、社会性・コミュニケーション障害など)[7、8]、およびその他の不適応行動(自傷、かんしゃく、攻撃性など)[9、10]の重症度を増悪させることが示されています。しかし、現在までのところ、ASD患者における睡眠プロファイルと行動問題の関係は限定的である。現在の睡眠治療は、低機能自閉症者における欠陥の特定の性質をターゲットにすることができない。本論文では、低機能自閉症児の睡眠プロファイルを同定することは、特にこの障害における挑戦的な行動に対する標的介入を同定するために必要であることを強調する。本総説は、方法論的考察で締めくくり、この集団に的を絞った治療を提供するために、睡眠障害をより明確に理解することを目的とした今後の研究への示唆を与えている。
低機能自閉症
ASDは顕著な表現型の異質性を特徴とし、それが病因、診断、治療、予後の研究の障害とみなされることが多い[11]。ASD患者の障害の程度は様々であるため、低機能自閉症と高機能自閉症を区別する必要があり、それぞれ知能指数が平均以下(<70)と平均以上(≥70)と定義される[1]。現在のDSM-Vが捉えていないのは,低機能自閉症の人々は,高機能自閉症の人々が経験するよりも有意に重い障害を経験しているということである[12]。ASDの中核的な症状を示すだけでなく,低機能自閉症の子どもの多くは,かんしゃく,攻撃性,環境破壊,社会的に不適切な行動,自傷行為などの深刻な行動障害を示すことがある[13]。したがって、低機能自閉症の子どもは、ASD症状の重症度や関連する併発症など、より複雑な診断像を持っている可能性が高く、生涯にわたって手厚いサポートを必要とすることが多い。今日まで、これらのグループは高機能自閉症者と比較して、同等の関心を持たれてこなかった。本論文では、これらのグループは、治療を最も必要とするため、今後の研究の焦点となるべきであると主張する。
ASDはしばしば併発する障害や関連する問題を伴いますが、そのひとつが睡眠障害です[14, 15]。ASDの子どもを持つ親や介護者の間で、最も負担が大きく深い不満のひとつが睡眠不足である。研究によると、ASDを持つ人の約40~80%が睡眠障害を経験し、そのリスクは認知障害の重症度とは無関係であるようです [16]。他の研究者は、低機能自閉症の人は、認知障害の程度と重症度を考えると、高機能の人と比べて、慢性的な睡眠覚醒周期障害への素因が高いことを示している[17]。この論文は、低機能自閉症における睡眠障害を理解し、特定し、治療することは、関連する症状や日中の行動に良い影響を与え、したがって、この集団の生活の質を向上させる可能性があると主張する。
ASDは多面的な障害であり、個人によって異なる症状プロファイルに反映されると考えられているため、この集団に多くの睡眠問題が蔓延していることは驚くには当たらない。さらに、ASDの睡眠プロファイルの多様性は、ASDサンプルの表現型プロファイルの混在を示唆するものである。ASD児では,睡眠潜時の延長,睡眠効率の低下,総睡眠時間の減少,睡眠開始後の覚醒の増加,就寝抵抗,日中の眠気などが最も多い睡眠問題である;総説は[18]を参照のこと。したがって、ASDの子どもを特徴づける特定の睡眠問題はなく、多くの睡眠問題があるようです。これらの睡眠障害は生涯を通じて持続するようであり [19]、1つの睡眠問題を経験したASDの人は、しばしば共存する睡眠問題を経験する [20]。これらの睡眠障害のいくつかは、睡眠障害の国際分類(ICSD-3)によれば、一次睡眠障害(例えば、不眠症、パラソムニア、概日リズム睡眠覚醒障害)として分類することができる[21]。表1では,ASDに存在する睡眠障害の範囲と広がりを感じてもらうために,ASDで最も多い睡眠問題をICSD-3の睡眠障害分類の広義基準に照らして報告した。これまで,ASDの睡眠を探る研究のほとんどは,高機能自閉症者,つまりアクチグラフや睡眠ポリグラフによる睡眠検査でコミュニケーションや協力ができる人に焦点を当ててきた [22]。現在、低機能自閉症における睡眠障害の性質と有病率についての理解は一貫していない。ある研究では、睡眠問題の重症度(入眠遅延や睡眠時間など)は自閉症症状(コミュニケーション障害など)の重症度とともに増加することが示唆されている[8]。別の研究では、自閉症の重症度の上昇は睡眠問題の可能性の上昇を予測することが示唆されている[23];しかしながら、これらの関連はまだ推測に過ぎず、低機能自閉症における睡眠プロファイルはまだ解明されていない。現在までのところ、低機能自閉症者に特有の睡眠問題と症状の関係についてはまだ不明である。
表1
表1
ASD児の睡眠障害に関するICSD-3分類(説明とエビデンスを含む
ASDの子どもにおける睡眠問題の病因は、非常に一般的で持続的であるにもかかわらず、依然として不明である [41]。睡眠障害は、i)ASDの状態、またはii)他の関連する併存疾患のいずれかの直接的な結果である可能性を示唆するいくつかの理論が提唱されている。神経生理学や神経化学の基礎にあるものが、ASD患者が慢性的な睡眠覚醒障害を持つ素因になる可能性があることが研究により示唆されている。概日リズムは生後12-16週で確立されるが、24時間周期の適切な同調(体内時計と外部時間の同調)を可能にするために、環境時間の手がかり("zeitgebers")を知覚することが必要である。最も強力な時間的手がかりは24時間の明暗サイクルであるが、食事のタイミングや社会的接触など、位相的でない時間的手がかりも影響を与えることがある。ASDのように脳の損傷や発達不全がある場合、これらの同調経路が損なわれることがある [19] 。低機能自閉症の子どもは、社会的な合図に対する感受性の低下、光感受性の変動による概日位相と課された明暗サイクルのズレなど、概日同調に影響を与える可能性のある多くの変数にさらされている [42]。また、メラトニン(睡眠覚醒サイクルを制御する神経ホルモン)分泌のタイミングに生物学的異常があるという証拠もある。ASD患者では対照群と比べて日中のメラトニンが高く、夜間のメラトニンが著しく少ないことが研究で示されています [43]。他の研究では、メラトニン産生にばらつきがあり、正常なメラトニンプロファイルを持つ人もいることから、ASDの人の中には、概日リズムの調節不全を持つサブグループがあることが示唆されています[43, 44]。また,メラトニン異常は知的障害を伴う他のいくつかの疾患でも見つかっており[45,46],ASDにおけるメラトニン所見の非特異性の問題が指摘されている[38]。とはいえ,初期の推測では,ASD児のサブセットにおけるメラトニンへの影響やリズムの変化が,睡眠スケジュールの違いにつながり,就寝時間や朝のルーチン周りの問題行動を認識する結果になる可能性が示唆された。
その他、睡眠障害はASDに見られる他の内科的・精神科的併発疾患に影響された二次的な状態である可能性を示唆する説も提唱されている。ASD児では胃腸障害(GI)が多く、50%以上の子どもが便秘や下痢を経験し、しばしば夜間を通してトイレ覚醒を誘発する[47]。発作やてんかんも低機能自閉症の子どもによく見られ(6~60%)、睡眠不足はしばしば発作を促進し、逆に発作は睡眠構造に悪影響を及ぼすことが研究で示されている[48]。ASDの子どもはまた、不安や注意欠陥/多動性障害(ADHD)などの精神疾患を併発する可能性が25~70%高く、不注意の症状や多動などの高い覚醒度を示す [49]。これらの状態は、睡眠前の覚醒に影響を与え、睡眠開始を著しく遅延させ、時間の経過とともに不眠症の発症に関連する可能性がある [50] 。抗精神病薬やセロトニン再取り込み阻害薬(SSRI)など、内科的・行動学的状態を治療するために知られている薬物も、ASDの睡眠覚醒サイクルを乱す可能性がある [18] 。ASDにおける睡眠障害の本質を理解することは,睡眠と特定の要因との間に多方向の関係が存在する複雑な動的過程である。そのような関係をさらに探求することで、メカニズムが解明され、ひいては低機能自閉症者の睡眠症状を軽減する効果的な治療戦略が示唆されるかもしれない。
自閉症の子どもにおける深刻な睡眠問題の証拠が増えているが、この集団における証拠に基づく睡眠治療に関する研究はほとんど存在しない [51] 。ASDにおける睡眠障害は、他の行動上の困難が優先される傾向があるため、しばしば未治療のまま無視されることがある [52] 。一部の研究は、就寝時間近くに投与した場合、睡眠開始潜時を減少させ、総睡眠時間を増加させるメラトニンの有効性を支持している [53, 54] 。これに対して、メラトニンは夜間覚醒を増加させ、睡眠維持を阻害することが知られているため、睡眠潜時が困難なASD児にのみ有効であるとする研究もある[55]。さらに、メラトニンの有効性は、睡眠障害の種類、環境因子、その他の関連する病状に影響される[56]。生物学的要因を除いた後、親による教育や行動的介入がASDの睡眠障害に対する治療の第一線となる [57] 。規則的な睡眠覚醒サイクルを促進するために環境を変えることに焦点を当てた睡眠衛生アプローチなどの行動的介入は、ASDの睡眠導入と維持の改善に効果的な介入であることが示されている[58]。睡眠衛生の基本原則には,適切な就寝時刻とセットルーチンの選択,テレビ視聴の最小化,夜間の感情・行動刺激の低減などが含まれる[16]。この行動的な治療アプローチは,平均的に言語能力が最小限または全くない低機能自閉症の人に最適である。しかし、現在、行動的治療アプローチの有効性は、小規模な研究に基づいており、客観的な睡眠測定が欠如しており、ASDに限らず様々な診断を持つ子どもを含めて実施されている[59]。光療法は概日性睡眠障害の患者の睡眠相を進めたり遅らせたりするのに有効であり,概日性機能障害を呈するASDの子どもに対して検討することができる[16];しかし,低機能自閉症の個人に対する光療法に関する研究は限定的である。ASDにおける不十分な睡眠,日中の問題行動の激化,および親のストレスとの関連を考えると,子どもの認知・発達レベルに適応した効果的な睡眠介入を開発することが強く求められている。
ASDにおける睡眠不足と挑戦的行動の関係
定型発達では、睡眠障害は内面化・外面化症状などの感情や行動の問題と関連しています[60]。さらに、小児期の睡眠障害は、子どもの健康、行動、注意、認知、学校の成績に広く影響を与える可能性があることを示す証拠が増えている [61] 。自閉症とそれに関連する挑戦的行動の性質を考えると、この障害における睡眠障害の影響は潜在的に深刻である。睡眠の問題は、ASDの症状を悪化させることが分かっている。睡眠時間の少なさは、社会的スキルの欠損 [41]、コミュニケーション障害、定型行動の割合の高さ、非機能的ルーチンの厳守など、より大きなASD重症度と相関し予測することが示されている [62]。ASD症状を悪化させることに加え,睡眠障害は,ASDの日中機能を著しく阻害しうる問題である過活動,混乱,非遵守,攻撃性,過敏性,感情問題の割合の増加と関連することが示されている[19,25,62,63]。表2は、睡眠と挑戦的行動の関係を調べたこれまでに行われた研究を発表日順に並べ、その方法、有意な所見、効果量によってまとめたものである。ASDにおける睡眠障害と挑戦的行動の関係を探る研究はあるものの,低機能自閉症児における睡眠障害の影響は軽視されてきた。さらに、これらの人における睡眠と行動の双方向の関係については、限られた研究しか行われていない。
表2
表2
ASDにおける睡眠と挑戦的行動の関係を探求した研究
今後の方向性:ASDにおける睡眠と行動の関係
研究分野 現在の研究では、ASD患者における睡眠と行動の間に明確な一方向の関係があることが明らかにされている。睡眠の問題は、既存の行動問題を悪化させるだけでなく、ほとんどの中核領域にわたってASD症状を悪化させることは、よく研究されていることである。これらの関係は、ASDサンプルの混合グループや高機能自閉症の個人を対象にした客観的な測定法を用いた横断的研究でかなりよく調べられている。睡眠ポリグラフ(脳波など睡眠中の生理的パラメータをモニターするツール)やリストアクチグラフ(加速度計を用いて筋活動を検出・記録するツール)などの客観的なツールを用いて,ASD児の混合サンプルにおける睡眠不足と日中の行動との関係の検証に成功している[51, 65, 71]。また,CSHQのような全体的な親の報告尺度が,ASD児の睡眠の全体的な質を測るのに役立つ優れた単項目回答尺度であることを示唆する控えめなエビデンスもある[76]。ASDにおける睡眠障害の重症度に関する知見に照らすと,睡眠はASDのある集団において治療に適応できることを示唆するエビデンスが存在する。親による教育(行動療法)が高機能自閉症児の睡眠開始遅延を改善すること[59]や,メラトニンなどの薬物療法が自閉症児に有効な睡眠治療であることを示す研究[77]がある。さらに,ASDのサブグループで睡眠を治療することで,ASDの中核症状(コミュニケーションや社会性の障害など)を改善するとともに,ASDの挑戦的行動の重症度を低下させることが示されている[38,68]。応用行動分析(ABA)治療アプローチは,少数派のASD児の挑戦的行動の治療に有効であることが知られているが[62],その成果は,学習速度や認知能力に影響される。睡眠がコンプライアンス、イライラ、多動、攻撃性など学習に影響を与える行動に関与していることを考えると、睡眠がASDにおけるABA治療の成功の障害となる可能性を示唆する証拠が増えてきたといえる[62]。ASDにおける挑戦的行動と睡眠障害の双方向の関係を考えると,睡眠障害と挑戦的行動を分離して治療しても,成功につながらない可能性があることを予備的な証拠が示唆している [50]。ASD児の睡眠問題と日中の不適切な行動との前述の関係から,特定の睡眠問題とASD児に影響を与える可能性のある日中の特定の行動パターンとの直接的な関連を明らかにするための追加研究が必要であることが示唆された。
今後の研究課題 これまでの研究で,ASDにおける睡眠不足と挑戦的行動の明確な関係が明らかにされてきたが,低機能自閉症者に特有の睡眠問題と症状の関係についてはまだ不明である。前述のように、現在の研究は主に自閉症スペクトラムの高機能側の個人に焦点を当てており、最も深刻な睡眠障害や行動障害を持つ可能性のある低機能自閉症の個人は、文献上では比較的無視されているのが現状である。すなわち、親の主観的な報告は報告バイアスと負のハロー効果をもたらし [78] 、個人は感覚過敏と協力不足のためにPSGやアクチグラフツールのような客観的測定に耐えられない [76] ことから、低機能自閉症児の睡眠研究には独特の方法論的課題が存在する。全米睡眠財団 [79] がASDの子どもを睡眠研究の最優先集団の一つとしていることを考えると、この集団における睡眠の質と量をよりよく特徴付けるために、より正確で客観的な非侵襲的睡眠測定と、低機能自閉症の子どもからのデータが必要である。
これまでの研究のもう一つの重要な限界は、ASDの行動問題や睡眠障害を縦断的に検討する研究が非常に少なく、ほとんどの研究が横断的であることである。横断的な研究では、ある特定の年齢提示におけるASDプロファイルを捉えるのみであり、ほとんどの研究では、サンプルに小児と青年の両方を組み合わせている。ASDにおいて睡眠が経時的にどのように変化するのか、またその変化にはどのような要因、例えば年齢や発達段階が関連するのかについてはほとんど分かっていない。ASDでは,ある研究では睡眠困難と発達段階(幼年期,青年期,成人期)との間に関連は認められなかったが [66] ,他の研究では,横断的ではあるが,定型発達と同様に年齢とともに睡眠困難が低下することが明らかにされている [36, 37] 。ASDの症状や行動障害の重症度は,発達に伴って増減することが知られており,年齢とともに改善する行動もある [80]。特定の年齢域で異なる行動プロファイルが生じること,ASDでは発達年齢が年代と一致しないことが多いことを考えると,縦断的なデザインによる関係性の研究が必要である。高機能自閉症と定型発達の対照群において,睡眠障害と行動の関係を縦断的に比較した研究は,現在までに1件しかない[75]。したがって,ASDの中核的な表現型を明らかにし,それらを睡眠プロファイルと関連付けるためには,この集団における睡眠の軌跡をたどり,どのような固有の変数が変化に影響を与えるかを理解するための,より多くの縦断的研究が必要である。例えば、ASDの睡眠障害は、薬の使用、季節の変化などの環境因子、てんかんや消化器系の問題などの併存疾患によって異なる可能性がある。ASDの行動問題を引き起こすのか、既存の問題を維持するのか、あるいはすでに存在する問題を悪化させるのか、併存する条件を判断することは困難である。この切実な問題を解決するための研究が必要である。
最後に、低機能自閉症者の挑戦的な行動を管理するための治療ガイドラインは、睡眠について全く触れていないか、非常に限定的な説明しかしていないことが多い。ASDの睡眠問題を特定し、治療を行うことは、睡眠の改善だけでなく、この集団の日中の行動や家族機能を改善することによって、より前向きな予後を促すために不可欠である。具体的な提案としては、研究者がASDの表現型をもたらす要因を特定し、特定の障害を逆転させたり改善させたりするために、的を絞った治療介入をデザインすることである。例えば、低機能自閉症児の場合、寝る前に強い刺激にさらされると、睡眠前の覚醒と入眠潜時が増加し、翌日の自己規制行動(自傷行為など)が増加する可能性がある。コンピュータやタブレットの画面から出る青色光への暴露による光感受性の高まりは、概日リズムやメラトニンの問題とも関連し、この集団における睡眠覚醒概日リズムの異常を増大させるかもしれない。ASDに固有の音過敏は、覚醒閾値の低下、睡眠の断片化などと関連している可能性がある。本論文では、睡眠障害の性質に基づいてASD児をプロファイリングすることで、症状や行動のプロフィールを理解し(あるいはその逆)、より的を射た介入につながる可能性があることを提案している。
結論
ASDの子どもには深刻な睡眠障害がよく見られ、睡眠不足が日中の問題行動を悪化させると考える根拠はあるが、これらの結論はまだ時期尚早であり、さらなる調査が必要である。ASDにおける睡眠障害の個人的性質についてより具体的な洞察を得ることは、睡眠が改善の可能性を持つ領域であることから、介入策をデザインするための新しい道を開くものである。睡眠は適応機能(学習、記憶、神経可塑性など)の中心的なメカニズムであるため、睡眠障害が挑戦的行動の増悪などASDにみられる症状に主要な役割を果たすことは非常に妥当なことである。しかし、これまでの研究では、睡眠と自閉症の低機能者(全年齢)にみられる行動との関係について、決定的な証拠は得られていない。このレビューでは、ASD児の睡眠プロファイルを定義し、症状プロファイルのさまざまな側面を睡眠障害に統合することの価値を強調している(その逆もまた然り)。そして、この知識は、この広汎性発達障害に罹患している68人に1人近い人々の長期的な転帰を改善することを望む、新しい治療標的および介入につながるだろう。
References
1. American Psychiatric Association . Diagnostic and Statistical Manual of Mental Disorders (DSM-V) 5. Arlington: American Psychiatric Association; 2013. [Google Scholar]
2. Baio J. Prevalence of autism spectrum disorder among children aged 8 years—Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2010. Suveillance Summ. 2014;63:1–21. [PubMed] [Google Scholar]
3. Comprehensive and Coordinated Efforts for the Management of Autism Spectrum Disorders. http://apps.who.int/gb/ebwha/pdf_files/EB133/B133_4-en.pdf
4. Meltzer LJ, Mindell JA. Behavioral sleep disorders in children and adolescents. Sleep Med Clin. 2008;3:269–279. doi: 10.1016/j.jsmc.2008.01.004. [CrossRef] [Google Scholar]
5. Reynolds AM, Malow BA. Sleep and autism spectrum disorders. Pediatr Clin North Am. 2011;58:685–698. doi: 10.1016/j.pcl.2011.03.009. [PubMed] [CrossRef] [Google Scholar]
6. Stores G, Wiggs L. Abnormal sleep patterns associated with autism: a brief review of research findings, assessment methods and treatment strategies. Autism. 1998;2:157–169. doi: 10.1177/1362361398022004. [CrossRef] [Google Scholar]
7. Park S, Cho S-C, Cho IH, Kim B-N, Kim J-W, Shin M-S, Chung U-S, Park T-W, Son J-W, Yoo HJ. Sleep problems and their correlates and comorbid psychopathology of children with autism spectrum disorders. Res Autism Spectr Disord. 2012;6:1068–1072. doi: 10.1016/j.rasd.2012.02.004. [CrossRef] [Google Scholar]
8. Tudor ME, Hoffman CD, Sweeney DP. Children with autism: sleep problems and symptom severity. Focus Autism Dev Disabil. 2012;27:254–262. doi: 10.1177/1088357612457989. [CrossRef] [Google Scholar]
9. Henderson JA, Barry TD, Bader SH, Jordan SS. The relation among sleep, routines, and externalizing behavior in children with an autism spectrum disorder. Res Autism Spectr Disord. 2011;5:758–767. doi: 10.1016/j.rasd.2010.09.003. [CrossRef] [Google Scholar]
10. Goldman SE, McGrew S, Johnson KP, Richdale AL, Clemons T, Malow BA. Sleep is associated with problem behaviors in children and adolescents with autism spectrum disorders. Res Autism Spectr Disord. 2011;5:1223–1229. doi: 10.1016/j.rasd.2011.01.010. [CrossRef] [Google Scholar]
11. Charman T, Jones CR, Pickles A, Simonoff E, Baird G, Happe F. Defining the cognitive phenotype of autism. Brain Res. 2011;1380:10–21. doi: 10.1016/j.brainres.2010.10.075. [PubMed] [CrossRef] [Google Scholar]
12. Chuileann S, Quigley J. Assessing recollection and familiarity in low functioning autism. J Autism Dev Disord. 2013;43:1406–1422. doi: 10.1007/s10803-012-1697-3.[PubMed] [CrossRef] [Google Scholar]
13. Kanne S, Gerber A, Quirmbach L, Sparrow S, Cicchetti D, Saulnier C. The role of adaptive behaviour in autism spectrum disorders: implications for functional outcome. J Autism Dev Disord. 2011;41:1007–1018. doi: 10.1007/s10803-010-1126-4. [PubMed] [CrossRef] [Google Scholar]
14. Lovullo SV, Matson JL. Comorbid psychopathology in adults with autism spectrum disorders and intellectual disabilities. Res Dev Disabil. 2009;30:1288–1296. doi: 10.1016/j.ridd.2009.05.004. [PubMed] [CrossRef] [Google Scholar]
15. Matson JL, Rivet TT. Characteristics of challenging behaviours in adults with autistic disorder, PDD-NOS, and intellectual disability. J Intellect Dev Disabil. 2008;33:323–329. doi: 10.1080/13668250802492600. [PubMed] [CrossRef] [Google Scholar]
16. Cortesi F, Giannotti F, Ivanenko A, Johnson K. Sleep in children with autistic spectrum disorder. Sleep Med. 2010;11:659–664. doi: 10.1016/j.sleep.2010.01.010.[PubMed] [CrossRef] [Google Scholar]
17. Sajith S, Clarke D. Melatonin and sleep disorders associated with intellectual disability: a clinical review. J Intellect Disabil Res. 2007;51:2–13. doi: 10.1111/j.1365-2788.2006.00893.x. [PubMed] [CrossRef] [Google Scholar]
18. Hollway JA, Aman MG. Sleep correlates of pervasive developmental disorders: a review of the literature. Res Dev Disabil. 2011;32:1399–1421. doi: 10.1016/j.ridd.2011.04.001.[PubMed] [CrossRef] [Google Scholar]
19. Matson JL, Ancona M, Wilkins J. Sleep disturbances in adults with autism spectrum disorders and severe intellectual impairments. J Ment Health Res Intellect Disabil. 2008;1:129–139. doi: 10.1080/19315860801988210.[CrossRef] [Google Scholar]
20. Liu X, Hubbard JA, Fabes RA, Adam JB. Sleep disturbances and correlates of children with autism spectrum disorders. Child Psychiatr Human Dev. 2006;37:179–191. doi: 10.1007/s10578-006-0028-3. [PubMed] [CrossRef] [Google Scholar]
21. American Academy of Sleep Medicine . International Classification of Sleep Disorders: Diagnostic & Coding Manual, ICSD-3. 3. Darien: American Academy of Sleep Medicine; 2014. [Google Scholar]
22. Allik E, Larsson JO, Smedje H. Sleep patterns in school aged children with Asperger syndrome or high functioning autism: a follow up study. J Autism Dev Disord. 2008;38:1625–1633. doi: 10.1007/s10803-008-0543-0.[PubMed] [CrossRef] [Google Scholar]
23. Adams H, Matson JL, Cervantes P, Goldin R. The relationship between autism symptom severity and sleep problems: should bi-directionality be considered? Res Autism Spectr Disord. 2014;8:193–199. doi: 10.1016/j.rasd.2013.11.008. [CrossRef] [Google Scholar]
24. Wiggs L, Stores G. Sleep patterns and sleep disorders in children with autistic spectrum disorders: insights using parent report and actigraphy. Dev Med and Child Neuro. 2004;46:372–380. doi: 10.1017/S0012162204000611. [PubMed] [CrossRef] [Google Scholar]
25. Malow B, Marzec M, McGrew S, Wang L, Henderson L, Stone W. Characterizing sleep in children with autism spectrum disorders: a multi-dimensional approach. Sleep. 2006;29:15–63. [PubMed] [Google Scholar]
26. Goodlin-Jones BL, Tang K, Liu J, Anders TF. Sleep patterns in preschool-age children with autism, developmental delay and typical development. J Am Acad Child Adolesc Psychiatry. 2008;47:932–940. [PubMed] [Google Scholar]
27. Krakowiak P, Goodlin-Jones B, Hertz-Picciotto I, Croen LA, Hansen RL. Sleep problems in children with autism spectrum disorders, developmental delays and typical development: a population based study. J Sleep Res. 2008;17:197–206. doi: 10.1111/j.1365-2869.2008.00650.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
28. Souders MC, Mason TB, Valladares O, Bucan M, Levy SE, Mandell D, Weaver TE, Pinto-Martin J. Sleep behaviors and sleep quality in children with autism spectrum disorders. Sleep. 2009;32:1566–1578.[PMC free article] [PubMed] [Google Scholar]
29. Anders TF, Iosif AM, Schwichtenberg AJ, Tang K, Goodlin-Jones BL. Six-month sleep-wake organization and stability in preschool-age children with autism, developmental delay, and typical development. Behav Sleep Medic. 2011;9:92–106. doi: 10.1080/15402002.2011.557991.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Giannotti F, Cortesi F, Cerquiglini A, Vagnoni C, Valente D. Sleep in children with autism with and without autistic regression. J Sleep Res. 2011;20:338–347. doi: 10.1111/j.1365-2869.2010.00882.x.[PubMed] [CrossRef] [Google Scholar]
31. Sivertsen B, Posserud MB, Gillberg C, Lundervold AJ, Hysing M. Sleep problems in children with autism spectrum problems: a longitudinal population-based study. Autism. 2012;16:139–150. doi: 10.1177/1362361311404255. [PubMed] [CrossRef] [Google Scholar]
32. Baker M, Richdale A, Short M, Gradisar M. An investigation of sleep patterns in adolescents with high-functioning autism spectrum disorder compared with typically developing adolescents. Dev Neurorehabil. 2013;16:155–165. doi: 10.3109/17518423.2013.765518.[PubMed] [CrossRef] [Google Scholar]
33. Hering E, Epstein R, Elroy S, Iancu D, Zelnik N. Sleep patterns in autistic children. J Autism Dev Disord. 1999;29:143–147. doi: 10.1023/A:1023092627223. [PubMed] [CrossRef] [Google Scholar]
34. Doo S, Wing YK. Sleep problems of children with pervasive developmental disorders: correlation with parental stress. Dev Med Child Neurol. 2006;48:650–655. doi: 10.1017/S001216220600137X. [PubMed] [CrossRef] [Google Scholar]
35. Schreck KA, Mulick JA. Parental report of sleep problems in children with autism. J Autism Dev Disord. 2000;30:127–135. doi: 10.1023/A:1005407622050. [PubMed] [CrossRef] [Google Scholar]
36. Goldman SE, Richdale AL, Clemons T, Malow BA. Parental sleep concerns in autism spectrum disorders: variations from childhood to adolescence. J Autism Dev Disord. 2012;42:531–538. doi: 10.1007/s10803-011-1270-5. [PubMed] [CrossRef] [Google Scholar]
37. Giannotti F, Cortesi F, Cerquiglini A, Miraglia D, Vagnoni C, Sebastiani T, Bernabei P. An investigation of sleep characteristics, EEG abnormalities and epilepsy in developmentally regressed and non-regressed children with autism. J Autism Dev Disord. 2008;38:1888–1897. doi: 10.1007/s10803-008-0584-4. [PubMed] [CrossRef] [Google Scholar]
38. Tordjman S, Najjar I, Bellissant E, Anderson G, Barburoth M, Cohen D, Jaafari N, Schischmanoff O, Fagard R, Lagdas E, Kermarrec S, Ribardiere S, Botbol M, Fougerou C, Bronsard G, Vernay-Leconte J. Advances in the research of melatonin in autism spectrum disorders: literature review and new perspectives. Int J Mol Sci. 2013;14:20509–20542. doi: 10.3390/ijms141020508.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
39. Hayashi E. Effect of melatonin on sleep-wake rhythm: the sleep diary of an autistic male. Psychiatr Clin Neurosci. 2000;54:383–384. doi: 10.1046/j.1440-1819.2000.00725.x.[PubMed] [CrossRef] [Google Scholar]
40. Segawa M. Epochs of development of the sleep-wake cycle reflect the modulation of the higher cortical function particular for each epoch. Sleep Biologi Rhythms. 2006;4:4–15. doi: 10.1111/j.1479-8425.2006.00205.x.[CrossRef] [Google Scholar]
41. Richdale AL, Schreck KA. Sleep problems in autism spectrum disorders: prevalence, nature, & possible biopsychosocial aetiologies. Sleep Med Rev. 2009;13:403–411. doi: 10.1016/j.smrv.2009.02.003. [PubMed] [CrossRef] [Google Scholar]
42. Glickman G. Circadian rhythms and sleep in children with autism. Neuroscience Biobehav Rev. 2010;34:755–768. doi: 10.1016/j.neubiorev.2009.11.017.[PubMed] [CrossRef] [Google Scholar]
43. Tordjman S, Anderson G, Bellissant E, Botbol M, Charbuy H, Camus F, Graignic R, Kermarrec S, Fougerou C, Cohen D, Touitou Y. Daytime and nighttime excretion of 6-sulphatoxymelatonin in adolescents and young adults with autistic disorder. Psychoneuroendocrinology. 2012;37:1990–1997. doi: 10.1016/j.psyneuen.2012.04.013.[PubMed] [CrossRef] [Google Scholar]
44. Leu RM, Beyderman L, Botzolakis EJ, Surdyka K, Wang L, Malow B. Relation of melatonin to sleep architecture in children with autism. J Autism Dev Disord. 2011;41:427–433. doi: 10.1007/s10803-010-1072-1.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
45. Miyamoto A, Oki J, Takahashi S, Okuno A. Serum melatonin kinetics and long-term melatonin treatment for sleep disorders in Rett syndrome. Brain Dev. 1999;21:59–62. doi: 10.1016/S0387-7604(98)00072-2.[PubMed] [CrossRef] [Google Scholar]
46. Yamashita Y, Matsuishi T, Murakami Y, Kato H. Sleep disorder in Rett syndrome and melatonin treatment. Brain Dev. 1999;21:570. doi: 10.1016/S0387-7604(99)00071-6.[PubMed] [CrossRef] [Google Scholar]
47. Mannion A, Leader G, Healy O. An investigation of comorbid psychological disorders, sleep problems, gastrointestinal symptoms and epilepsy in children and adolescents with autism spectrum disorder. Res Autism Spectr Disord. 2013;7:35–42. doi: 10.1016/j.rasd.2012.05.002. [CrossRef] [Google Scholar]
48. Malow B. Sleep disorders, epilepsy and autism. Ment Retard Dev Disab Res Rev. 2004;10:122–125. doi: 10.1002/mrdd.20023.[PubMed] [CrossRef] [Google Scholar]
49. Tureck K, Matson JL, May A, Turygin N. Externalizing and tantrum behaviours in children with ASD and ADHD compared to children with ADHD. Dev Neurorehabil. 2013;16:52–57. doi: 10.3109/17518423.2012.719245.[PubMed] [CrossRef] [Google Scholar]
50. Richdale AL, Baker E, Short M, Gradisar M. The role of insomnia, pre-sleep arousal and psychopathology symptoms in daytime impairment in adolescents with high functioning autism spectrum disorder. Sleep Med. 2014;15:1082–1088. doi: 10.1016/j.sleep.2014.05.005. [PubMed] [CrossRef] [Google Scholar]
51. Knight R, Johnson C. Using behavioural treatment package for sleep problems in autism spectrum disorders. Child Fam Behav Ther. 2014;36:204–221. doi: 10.1080/07317107.2014.934171.[CrossRef] [Google Scholar]
52. Cortesi F, Giannotti F, Sebastiani T, Panunzi S, Valente D. Controlled-release melatonin, singly and combined with cognitive behavioural therapy for persistent insomnia in children with autism spectrum disorders: a randomised placebo control trial. J Sleep Res. 2012;21:700–709. doi: 10.1111/j.1365-2869.2012.01021.x. [PubMed] [CrossRef] [Google Scholar]
53. Doge N, Wilson G. Melatonin for treatment of sleep disorders in children with developmental disabilities. J Child Neurol. 2001;16:581–584. doi: 10.1177/088307380101600808. [PubMed] [CrossRef] [Google Scholar]
54. Goldman S, Adkins K, Calcutt M, Cater M, Goodpaster R, Wang L, Shi Y, Burgess H, Hachey D, Malow B. Melatonin in children with autism spectrum disorders: endogenous and pharmacokinetic profiles in relation to sleep. J Autism Dev Disord. 2014;44:2525–2535. doi: 10.1007/s10803-014-2123-9.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
55. Rossignol DA, Frye RE. Melatonin in autism spectrum disorders: a systematic review and meta-analysis. Dev Med Child Neurol. 2011;53:783–792. doi: 10.1111/j.1469-8749.2011.03980.x. [PubMed] [CrossRef] [Google Scholar]
56. Damaiani J, Sweet B, Sohoni P. Melatonin: an option for managing sleep disorders in children with autism spectrum disorder. Am J Health Syst Pharm. 2014;71:95–101. doi: 10.2146/ajhp130215. [PubMed] [CrossRef] [Google Scholar]
57. Grigg-Damberger M, Ralls F. Treatment strategies for complex behavioral insomnia in children with neurodevelopmental disorders. Curr Opin Pulmin Med. 2013;19:616–625. doi: 10.1097/MCP.0b013e328365ab89.[PubMed] [CrossRef] [Google Scholar]
58. Weiskop S, Richdale AL, Mathews J. Behavioural treatment to reduce sleep problems with autism and fragile X syndrome. Develop Med Child Neurol. 2005;47:94–104. doi: 10.1017/S0012162205000186. [PubMed] [CrossRef] [Google Scholar]
59. Malow B, Adkins K, Reynolds AM, Weiss S, Loh A, Fawkes D, Katz T, Goldman S, Madduri N, Hundley R, Clemons T. Parent based sleep education for children with autism spectrum disorders. J Autism Develop Disord. 2014;44:216–228. doi: 10.1007/s10803-013-1866-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
60. Gregory AM, Sadeh A. Sleep, emotional and behavioral difficulties in children and adolescents. Sleep Med Rev. 2012;16:129–136. doi: 10.1016/j.smrv.2011.03.007. [PubMed] [CrossRef] [Google Scholar]
61. Chen F, Lemonnier E, Lazartigues A, Plache P. Sleep problems and information processing, a “disconnection effect” in autism? Med Hypotheses. 2006;66:1245–1246. doi: 10.1016/j.mehy.2006.01.004. [PubMed] [CrossRef] [Google Scholar]
62. Schreck K, Mulick JA, Smith AF. Sleep problems as possible predictors of intensified symptoms of autism. Res Dev Disabil. 2004;25:57–66. doi: 10.1016/j.ridd.2003.04.007. [PubMed] [CrossRef] [Google Scholar]
63. Williams P, Sears L, Allard A. Sleep problems in children with autism. J Sleep Res. 2004;13:265–268. doi: 10.1111/j.1365-2869.2004.00405.x. [PubMed] [CrossRef] [Google Scholar]
64. DeVincent CJ, Gadow KD, Delosh D, Geller L. Sleep disturbance and its relation to DSM-IV psychiatric symptoms in preschool-age children with pervasive developmental disorder and community controls. J Child Neurol. 2007;22:161–169. doi: 10.1177/0883073807300310. [PubMed] [CrossRef] [Google Scholar]
65. Goodlin-Jones B, Tang K, Liu J, Anders TF. Sleep problems, sleepiness and daytime behavior in preschool-age children. J Child Psychol Psychiatr. 2009;50:1532–1540. doi: 10.1111/j.1469-7610.2009.02110.x.[PubMed] [CrossRef] [Google Scholar]
66. Mayes SD, Calhoun SL. Variables related to sleep problems in children with autism. Res Autism Spectr Disord. 2009;3:931–941. doi: 10.1016/j.rasd.2009.04.002. [CrossRef] [Google Scholar]
67. Goldman SE, Surdyka K, Cuevas R, Adkins K, Wang L, Malow BA. Defining the sleep phenotype in children with autism. Dev Neuropsychol. 2009;34:560–573. doi: 10.1080/87565640903133509.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
68. Moon EC, Corkum P, Smith IM. Case study: a case-series evaluation of a behavioral sleep intervention for three children with autism and primary insomnia. J Pediatr Psychol. 2011;36:47–54. doi: 10.1093/jpepsy/jsq057. [PubMed] [CrossRef] [Google Scholar]
69. Rzepecka H, McKenzie K, McClure I, Murphy S. Sleep, anxiety and challenging behaviour in children with intellectual disability and/or autism spectrum disorder. Res Dev Disabil. 2011;32:2758–2766. doi: 10.1016/j.ridd.2011.05.034. [PubMed] [CrossRef] [Google Scholar]
70. Sikora DM, Johnson K, Clemons T, Katz T. The relationship between sleep problems and daytime behavior in children of different ages with autism spectrum disorders. Pediatrics. 2012;130(Suppl 2):S83–S90. doi: 10.1542/peds.2012-0900F. [PubMed] [CrossRef] [Google Scholar]
71. Anders T, Iosif AM, Schwichtenberg AJ, Tang K, Goodlin-Jones B. Sleep and daytime functioning: a short-term longitudinal study of three preschool-age comparison groups. A J Intell Dev Disabil. 2012;117:275–290. doi: 10.1352/1944-7558-117.4.275.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
72. Taylor MA, Schreck KA, Mulick JA. Sleep disruption as a correlate to cognitive and adaptive behavior problems in autism spectrum disorders. Res Develop Disabil. 2012;33:1408–1417. doi: 10.1016/j.ridd.2012.03.013.[PubMed] [CrossRef] [Google Scholar]
73. Hollway JA, Aman MG, Butter E. Correlates and risk markers for sleep disturbance in participants of the autism treatment network. J Autism Dev Disord. 2013;43:2830–2843. doi: 10.1007/s10803-013-1830-y. [PubMed] [CrossRef] [Google Scholar]
74. Schwichtenberg AJ, Young GS, Hutman T, Iosif AM, Sigman M, Rogers SJ, Ozonoff S. Behavior and sleep problems in children with a family history of autism. Autism Res. 2013;6:169–176. doi: 10.1002/aur.1278.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
75. May T, Cornish KM, Conduit R, Rajaratnam SW, Rinehart NJ. Sleep in high functioning children with autism: longitudinal developmental change and associations with behavior problems. Behav Sleep Med. 2013;12:1–17. [PubMed] [Google Scholar]
76. Hodge D, Parnell AMN, Hoffman CD, Sweeney DP. Methods for assessing sleep in children with autism spectrum disorders: a review. Res Autism Spectr Disord. 2012;6:1337–1344. doi: 10.1016/j.rasd.2012.05.009. [CrossRef] [Google Scholar]
77. Guenole F, Godbout R, Nicolas A, Franco P, Claustrat B, Baleyte JM. Melatonin for disordered sleep in individuals with autism spectrum disorders: systematic review and discussion. Sleep Med Rev. 2011;15:379–387. doi: 10.1016/j.smrv.2011.02.001. [PubMed] [CrossRef] [Google Scholar]
78. Kotagal S, Broomall E. Sleep in children with autism spectrum disorder. Pediatr Neurol. 2012;47:242–251. doi: 10.1016/j.pediatrneurol.2012.05.007.[PubMed] [CrossRef] [Google Scholar]
79. Mindell JA, Meltzer LJ, Carskadon MA, Chervin RD. Developmental aspects of sleep hygiene: findings from the 2004 national sleep foundation sleep in America Poll. Sleep Medicine. 2009;10:711–779. doi: 10.1016/j.sleep.2008.07.016. [PubMed] [CrossRef] [Google Scholar]
80. Matson JL, Wilkins J, Macken J. The relationship of challenging behaviours to severity and symptoms of autism spectrum disorders. J Ment Health Res Intellect Disabil. 2009;2:29–44. doi: 10.1080/19315860802611415. [CrossRef] [Google Scholar]